庄诗美教授团队鉴定调控肝癌转移的“双刃剑”
近日,庄诗美教授团队在国际肝病学权威杂志Journal of Hepatology在线发表题为“Dual and opposing roles of the androgen receptor in VETC-dependent and invasion-dependent metastasis of hepatocellular carcinoma”的论文。拉斯维加斯lswjs0567官方网站为第一作者单位,拉斯维加斯lswjs0567官方网站周慧超博士为论文第一作者,庄诗美教授为最后通讯作者,中山大学生命科学学院方坚鸿副教授为共同通讯作者。本文的发表是学校基础研究团队和拉斯维加斯lswjs0567官方网站临床团队通力合作的又一重大成果。
经典理论认为,癌细胞转移时,必须运动并侵袭周围基质及血管壁。庄诗美教授团队在2015年揭示肝癌中一类新型血管,它们相连成网,将肝癌组织分割并完全包绕,称之肿瘤包绕型血管(VETC);VETC存在于约40%的肝癌中,癌细胞分泌的Angiopoietin-2(Angpt2)是促进VETC形成的必要因子;VETC能够帮助癌细胞在血管内皮的包裹中成团释放入血,为肝癌提供了一种依赖于VETC结构的、侵袭非依赖的高效转移模式,而非VETC肝癌则主要以侵袭依赖的方式转移(Hepatology 2015;封面论文、亮点推介、专家评述)。该团队还在2019年的Hepatology封面论文中,发现VETC可作为选择索拉非尼治疗敏感患者的指征。这些发现提示基于肿瘤血管结构异质性的肝癌转移调控机制及治疗的研究具有重要的意义。
雄激素受体(AR)属于核激素受体超家族成员,具有促进或抑制转录的功能。虽然大量实验证据提示AR促进肝癌的发生,但AR在肝癌转移中的作用的研究结果很不一致,AR抑制剂治疗肝癌的临床试验因疗效不佳而终止。近日,庄教授团队发现AR是调控VETC形成的关键分子,AR在肝癌不同转移模式中发挥双重且对立的作用。该研究首先从临床标本出发,发现在具有VETC的肝癌组织中,AR表达显著降低。结合肝癌组织、细胞和动物模型的研究结果显示:AR可抑制Angpt2的转录;在可诱导VETC形成的肝癌细胞中回复AR的表达,可通过降低Angpt2的表达和分泌,进而抑制VETC的形成及VETC依赖的肝内转移,但却促进癌细胞发生侵袭依赖的肺转移。进一步研究揭示,AR高表达可通过上调Rac1的蛋白水平,增强癌细胞片状伪足的形成,最终促进侵袭依赖的转移。综上所述,AR是肝癌转移过程中的一把“双刃剑”,能够抑制VETC依赖的转移但却促进侵袭依赖的转移。该研究揭示了AR的多面性及肝癌转移调控的复杂性,同时强调了基于肿瘤血管结构异质性的个体化治疗的重要性,为抗转移分子靶向药物的研发提供了理论依据。
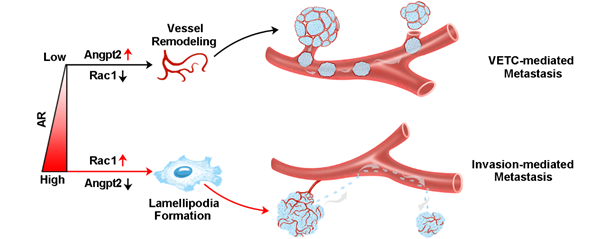
AR调控肝癌不同转移方式的机制
原文链接:
https://www.journal-of-hepatology.eu/article/S0168-8278(21)00331-7/fulltext







