【中心科研】邱伟/汤常永团队Glia发文:揭示依达拉奉通过激活mTORC1信号通路促进NMOSD髓鞘再生的作用
视神经脊髓炎谱系疾病(NMOSD)是一种由免疫介导的中枢神经系统(CNS)脱髓鞘疾病。迄今为止,仍然缺乏有效的治疗手段促进NMOSD受损神经再生修复,延缓疾病进展。髓鞘再生有助于恢复轴突神经冲动传导,改善疾病预后,可作为NMOSD受损神经再生修复的潜在治疗策略。
近日,拉斯维加斯lswjs0567官方网站脑病中心邱伟/汤常永教授团队在国际神经科学经典期刊Glia (中科院医学大类1区,TOP期刊,IF 8.07)发表了题为“Remyelination in neuromyelitis optica spectrum disorder is promoted by edaravone through mTORC1 signaling activation”的研究论文。邱伟教授与拉斯维加斯lswjs0567官方网站“百人引进”汤常永副研究员为共同通讯作者,课题组成员罗文静博士和徐辉明博士为论文共同第一作者。美国Mayo clinic伍龙军教授,清华大学崔亚雄博士后等为论文共同作者,日本庆应义塾大学Yoichiro Abe教授等对研究给予了支持。

▲图1:原文链接https://doi.org/10.1002/glia.24271
课题组发现,在体外条件下,传统氧自由基清除剂依达拉奉(EDA)可促进少突胶质前体细胞(OPC)向成熟少突胶质细胞(OL)分化及受损髓鞘再生(图2)。随后在在体条件下,分别通过来源于NMOSD患者的纯化NMO-IgG及对小鼠AQP4胞外域(E5415B)特异的单克隆AQP4-IgG构建小鼠脑实质局部注射模型,验证EDA的髓鞘再生作用(图3)。在此基础上,通过预破坏小鼠BBB后连续腹腔注射NMO-IgG构建NMOSD全身模型,进一步发现,EDA可通过减少脊髓髓鞘损伤改善NMOSD小鼠运动功能障碍(图4)。NMOSD患者活检脑组织中哺乳动物雷帕霉素靶蛋白复合物1(mTORC1)活性下降(图5)。使用mTORC1抑制剂雷帕霉素(RAPA)及激动剂NV-5138调控信号通路活性,发现EDA可能通过激活mTORC1促进损伤髓鞘的再生修复(图6)。
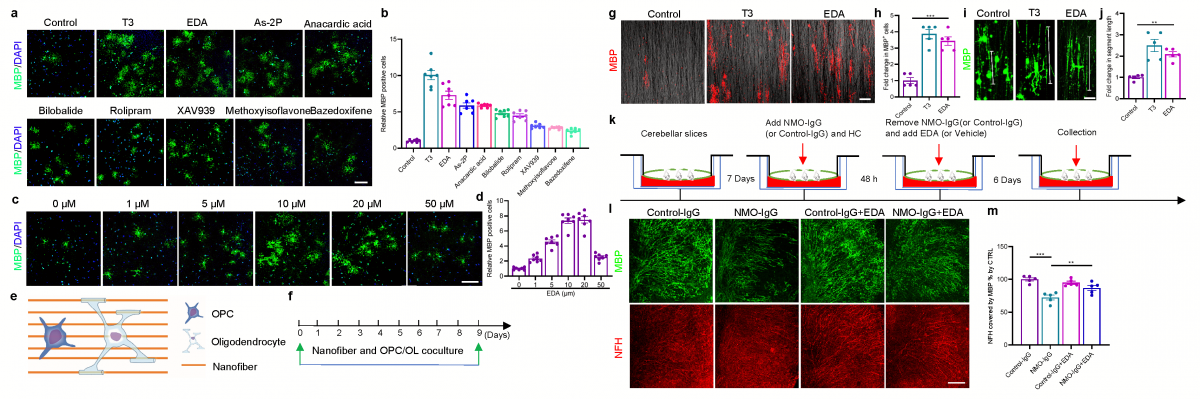
▲图2:EDA促进OPC向成熟OL分化(a-d);EDA促进OPC-纳米纤维共培养体系髓鞘形成(e-j);EDA促进NMOSD器官型脑片髓鞘再生(k-m)。
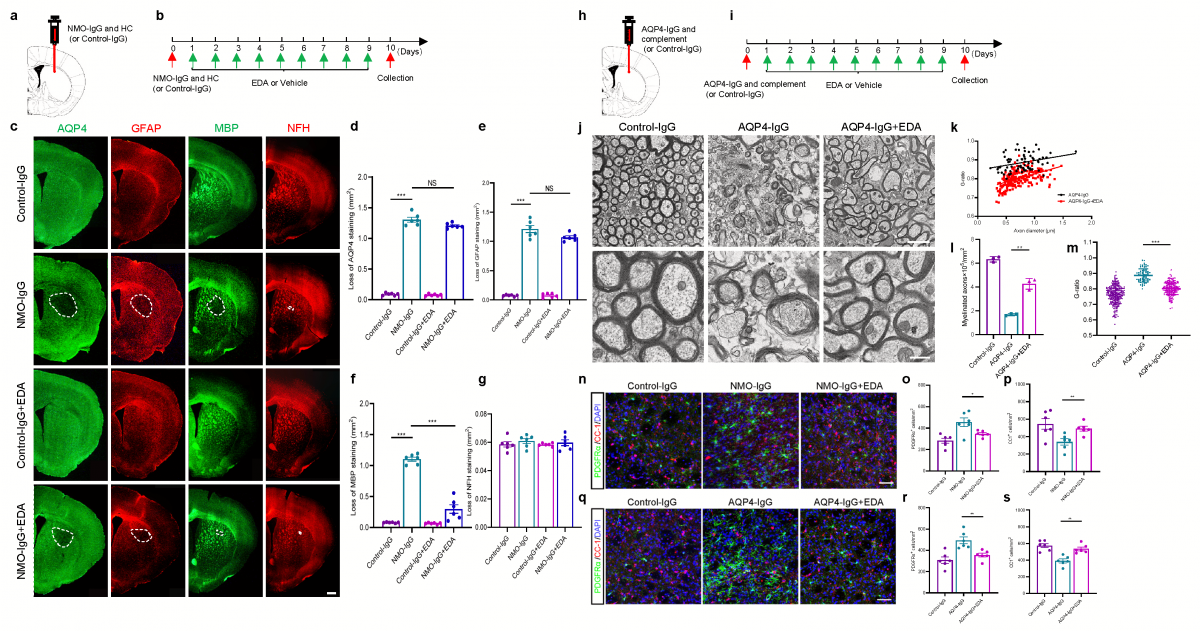
▲图3 EDA促进NMOSD脑实质局部注射模型小鼠髓鞘再生(a-g);电镜示EDA使有髓轴突数量增多,新生髓鞘厚度增加(h-m);EDA促进NMOSD局部模型小鼠病变中OPC向成熟OL分化(n-s)。
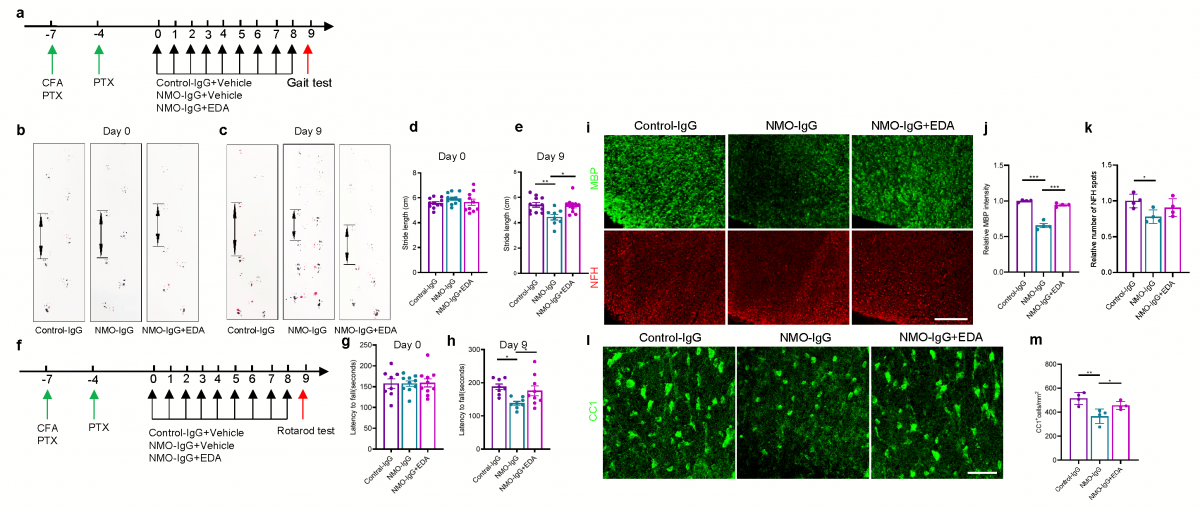
▲图4 步态分析及疲劳转棒试验提示EDA改善NMOSD全身模型小鼠运动功能障碍(a-h);EDA减少NMOSD全身模型小鼠脊髓髓鞘损伤及OL丢失(i-m)。
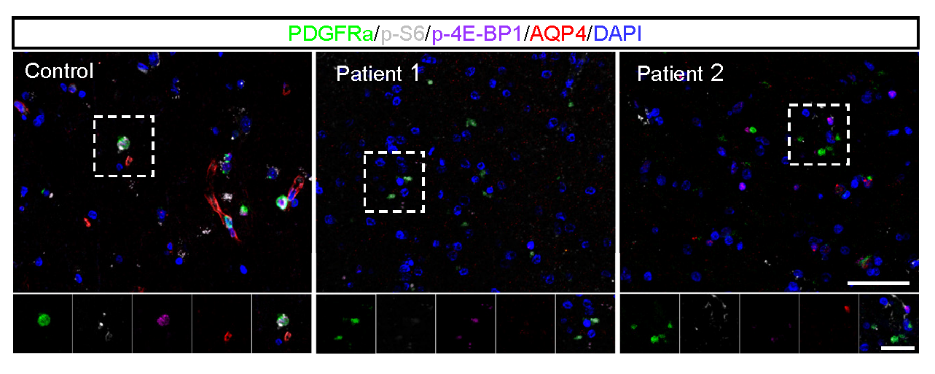
▲图5 与对照者相比,NMOSD患者活检脑组织中mTORC1活性下降。
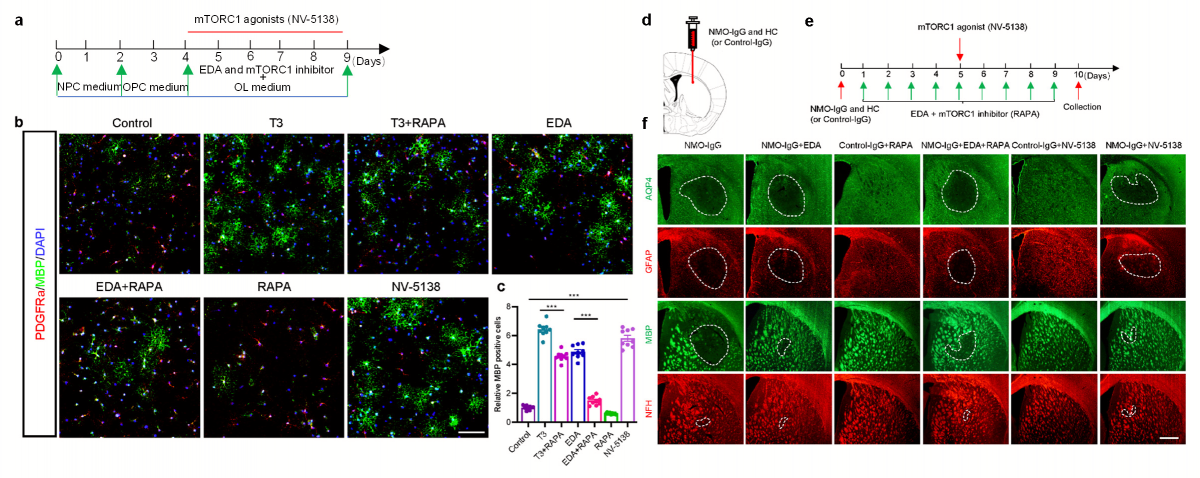
▲图6 EDA激活mTORC1信号通路促进OPC向成熟OL分化(a-c);抑制mTORC1通路逆转EDA促髓鞘再生作用(d-f)。
本课题借助多种NMOSD实验动物模型,从细胞、动物及人体脑组织标本等层面,探寻并验证可促进髓鞘再生的治疗策略,较系统地研究了EDA对NMOSD髓鞘再生的作用及分子机制,为NMOSD的神经再生治疗提供了新的思路,也为下一步开展EDA药物临床试验奠定了理论基础。
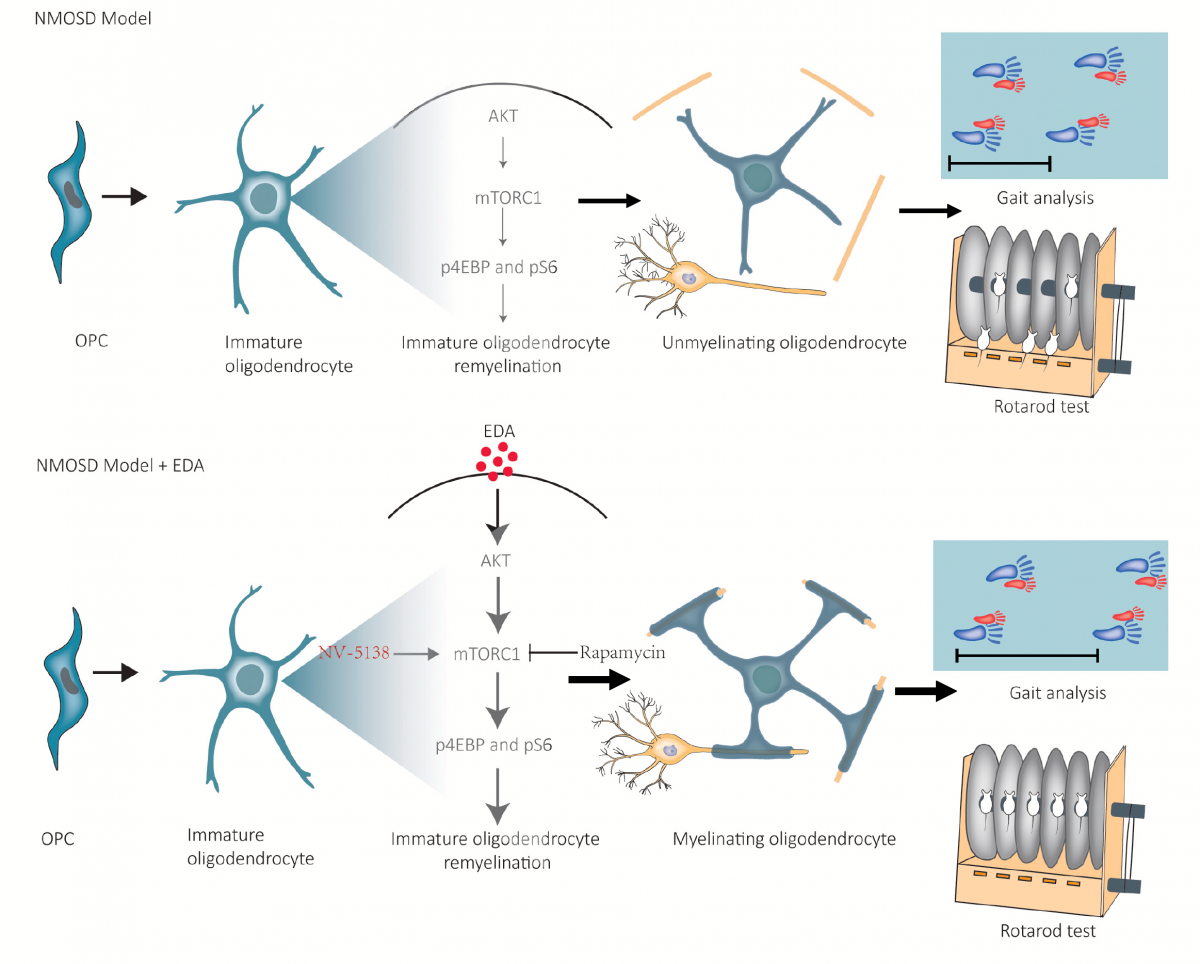
▲图7 EDA通过激活mTORC1信号通路促进NMOSD髓鞘再生的机制示意图
通讯作者

邱伟
拉斯维加斯lswjs0567官方网站脑病中心教授,博士生导师,神经免疫性疾病领域国内知名专家

汤常永
拉斯维加斯lswjs0567官方网站“百人引进”副研究员,硕士生导师,在Neuron 等发表第一作者论文
第一作者

罗文静
拉斯维加斯lswjs0567官方网站脑病中心博士研究生

徐辉明
拉斯维加斯lswjs0567官方网站脑病中心博士研究生
脑病中心神经免疫亚专科在胡学强、邱伟等教授的带领下,经过数十年的发展,已成为国内有影响力的亚专科。神经免疫团队近年来在NMOSD等多个研究方向上屡获进展,该研究成果将进一步推动NMOSD等神经免疫疾病临床与基础研究。







