赵绮毅团队取得肿瘤微环境研究新进展
肿瘤干细胞在肿瘤耐药中起着至关重要的作用。新近发现,肿瘤干细胞的干性(stemness)需要生物机械力环境维持,但生物机械力如何调节肿瘤微环境及其临床意义尚不清楚。近日,拉斯维加斯lswjs0567官方网站赵绮毅副研究员与中山大学孙逸仙纪念医院廖建友副研究员、双聘教授苏士成团队合作,在Nature子刊《Nature Communications》(一区,IF = 17.694)在线发表题为“Niche Stiffness Sustains Cancer Stemness via TAZ and NANOG Phase Separation”的最新研究成果,揭示了生物机械力参与调节肿瘤微环境的新机制,提示肿瘤微环境中的生物机械力是治疗肿瘤耐药的潜在靶点。
既往研究表明,肿瘤微环境中的生化因素(包括细胞因子、膜蛋白和细胞外囊泡中的非编码RNAs等)能诱导和维持肿瘤干细胞的干性和耐药性。新近研究发现,肿瘤微环境中除生化因素外,物理因素(如生物机械力)也在组织发育和稳态中发挥关键作用,二者共同决定肿瘤干细胞的命运和肿瘤治疗反应。然而,微环境生物力学信号维持肿瘤干细胞的干性机制尚不清楚。肿瘤干细胞也存在于肿瘤微环境中,微环境维持了肿瘤干细胞的分化多能性,并保护其免受药物和免疫反应的影响。
研究团队利用肿瘤临床标本和动物移植瘤型,发现肿瘤基质硬度的增加与肿瘤患者对新辅助化疗反应差和肿瘤干细胞富集存在关联;研究还进一步证明了“液-液相分离”机制作为肿瘤干细胞中生物机械力与干细胞转录因子转录活性之间信号纽带的作用机制,响应细胞外机械力的机械传感器与细胞的内生化信号通路耦合,从而调节细胞行为;同时,研究团队通过机制研究证明了机械转导分子TAZ被生态位机械力激活后,与干细胞转录因子NANOG的N端结构域发生相分离,进而促进干性相关基因SOX2和OCT4的转录。
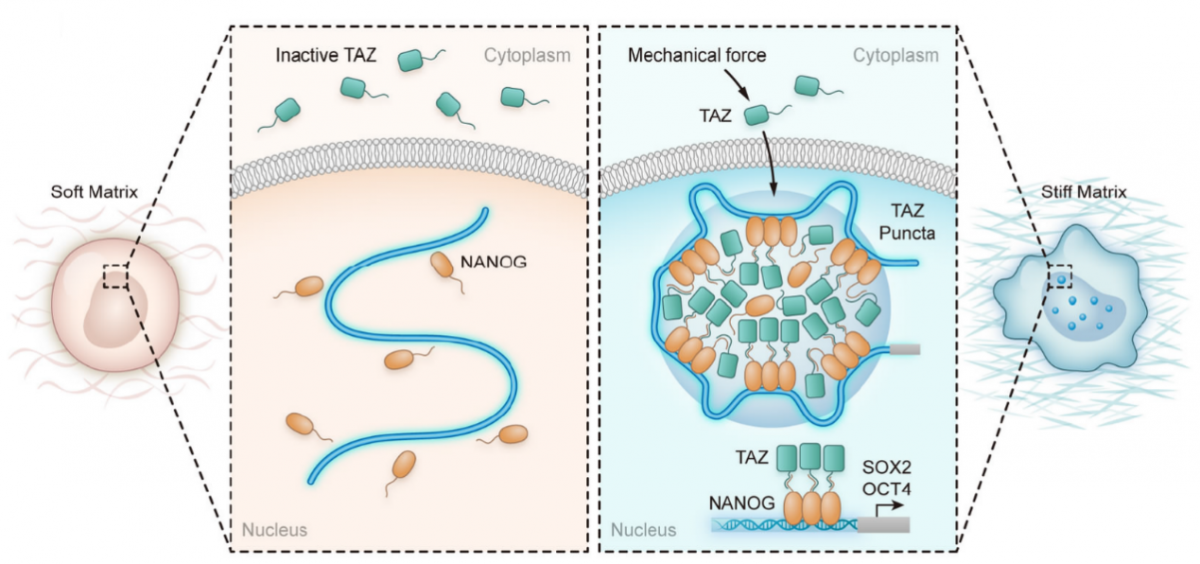
图1:研究发现肿瘤干细胞生态位硬度增加时,生物机械力转导分子TAZ被微环境机械力激活进入胞核,进而与干细胞转录因子NANOG的N端结构域发生液-相分离,促使NANOG结合到干性相关基因SOX2和OCT4的启动子区域,促进SOX2和OCT4转录,维持肿瘤干细胞相关特性。揭示了生物机械力参与调节肿瘤微环境的新机制,提示肿瘤微环境中的生物机械力是治疗肿瘤耐药的潜在靶点。
论文链接:https://www.nature.com/articles/s41467-023-35856-y







