拉斯维加斯lswjs0567官方网站邱伟、中科院王杰、香港中文大学刘晓东:首次构建人源化抗NMDAR脑炎模型并揭示发病机制及治疗靶点
近日,拉斯维加斯lswjs0567官方网站脑病中心邱伟等联合中国科学院精密测量科学与技术创新研究院王杰、香港中文大学刘晓东教授在神经科学知名期刊Journal of Neuroinflammation (中科院一区,TOP期刊,IF=9.3)上发表了题为“Transfer of patient’s peripheral blood mononuclear cells (PBMCs) disrupts blood–brain barrier and induces anti-NMDAR encephalitis: a study of novel humanized PBMC mouse model”的研究论文。拉斯维加斯lswjs0567官方网站舒崖清、彭富华为共同第一作者,邱伟、王杰、刘晓东为共同通讯作者。该研究得到了中山大学中山医学院王琴、中山大学附属第一医院冯慧宇、华南农业大学孙坚、德国Borstel研究中心余新华教授指导。
自身免疫性脑炎是一种中枢免疫性疾病,2018年被国家罕见病目录纳入,其中抗N-甲基-D-天冬氨酸受体(NMDAR)脑炎最为常见,其病因及发病机制不详,部分患者预后差,给家庭和社会带来沉重负担。聚焦抗NMDAR脑炎发病机制,寻找治疗靶点尤为迫切。

图1:文章信息
该研究首次构建了PBMC诱导的人源化小鼠模型:课题组分别将抗NMDAR脑炎患者、健康受试者的PBMC(外周血单核细胞)通过腹腔注射至重度免疫缺陷小鼠-BRGSF小鼠中(图2A),人源的免疫细胞可以在小鼠的血、脾、骨髓中存活(图2B),小鼠脾脏形成类似于生化中心的结构(图2C)。而且,实验模型小鼠的血、脑脊液中有抗NMDAR抗体(抗GLuN1抗体)产生(图2D-F),模型小鼠脑组织中GLuN1表达下调(图2G,H);进一步行为学检测还发现模型小鼠精神行为存在异常(图2I);通过9T功能MRI成像也显示实验模型小鼠脑功能紊乱和脑结构轻度萎缩(图2J)。
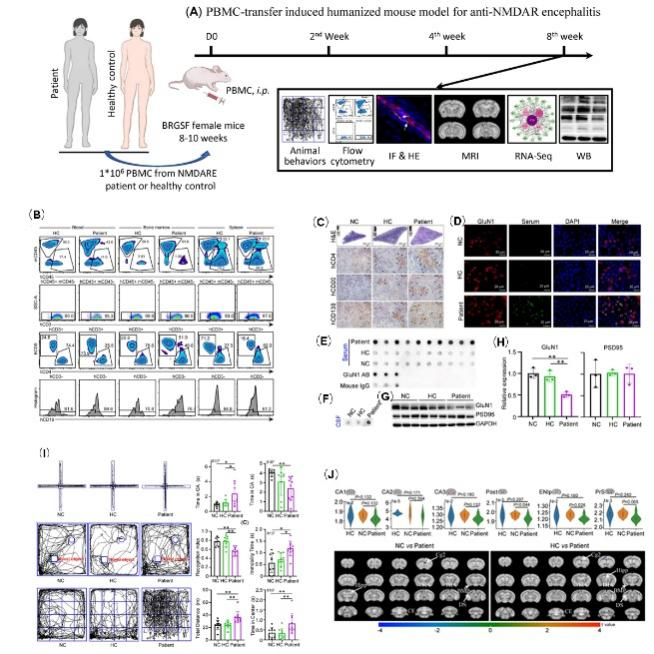
图2:PBMC诱导的人源化小鼠模型
该研究发现,模型小鼠存在明显的血脑屏障(BBB)破坏及紧密连接蛋白如Claudin-1\Occludin\ZO-1\Claudin-5蛋白下调(图3A-C);并发现模型小鼠脑膜中有人B细胞、人T细胞浸润(图3D),且模型小鼠海马存在CD8+T细胞浸润(图3E)。
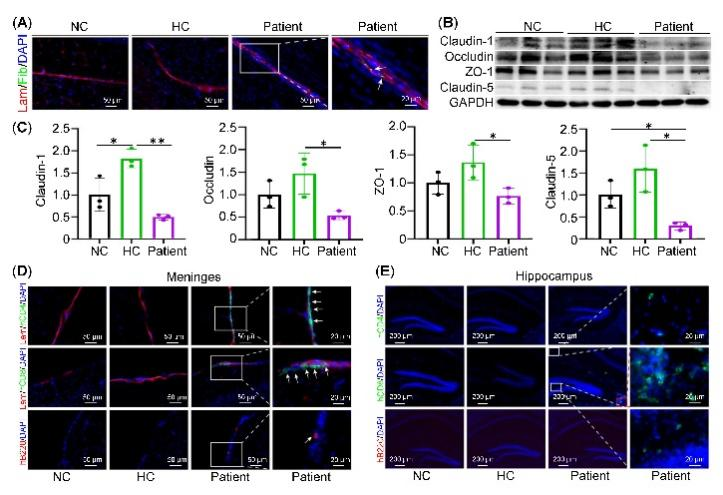
图3
该研究进一步发现,PBMC通过上调BBB内皮细胞IL-1β表达以促进BBB的破坏。研究人员通过转录组学、免疫荧光、蛋白印迹等鉴定了PBMC通过上调IL-1β介导模型小鼠BBB破坏(图4A-J),并在体外BBB模型中对内皮细胞 Il-1β 进行敲除也发现敲除 Il-1β 后BBB破坏明显减轻(图4K-O)。
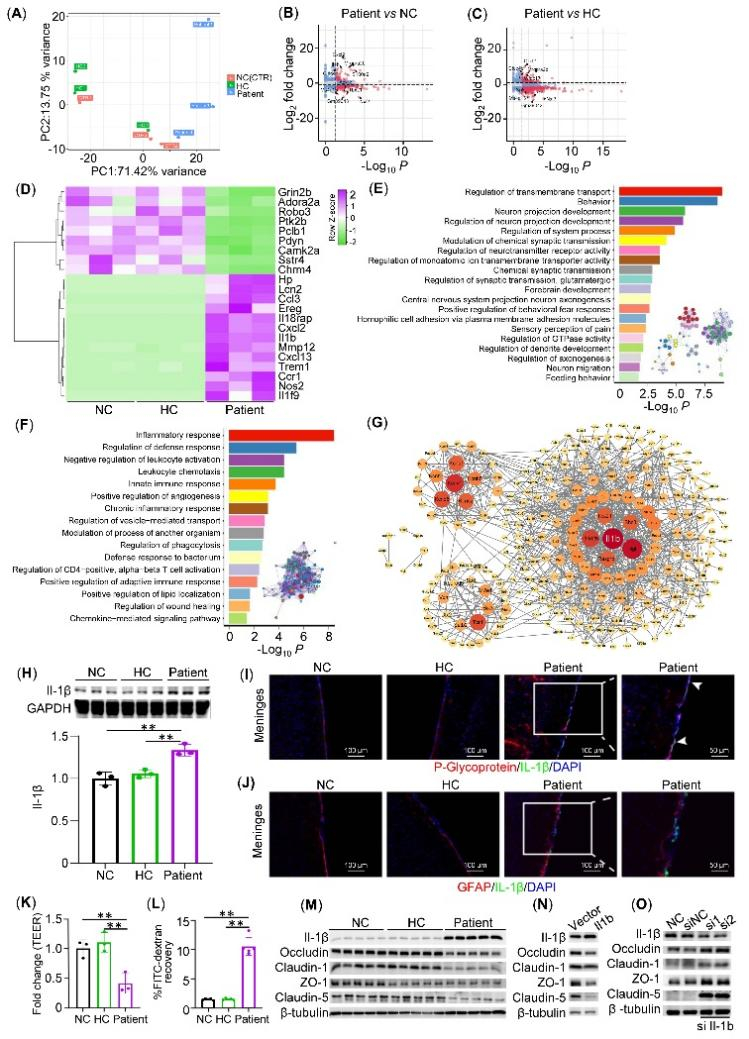
图4
最后,该研究明确了IL-1受体拮抗剂(Anakinra, 阿那白滞素)对BBB的保护作用并可缓解模型小鼠的病情。课题组首次发现,在体外BBB模型上,Anakinra上调紧密连接蛋白ZO-1\Occludin\Claudin-5表达(图5B)及缓解患者PBMC对BBB模型完整性的破坏(图5C,D);在抗NMDAR脑炎人源化模型小鼠上也发现Anakinra可以改善小鼠的精神行为异常(图5E-G)、上调脑组织紧密连接蛋白以及海马组织中GluN1的表达(图5H-J)。
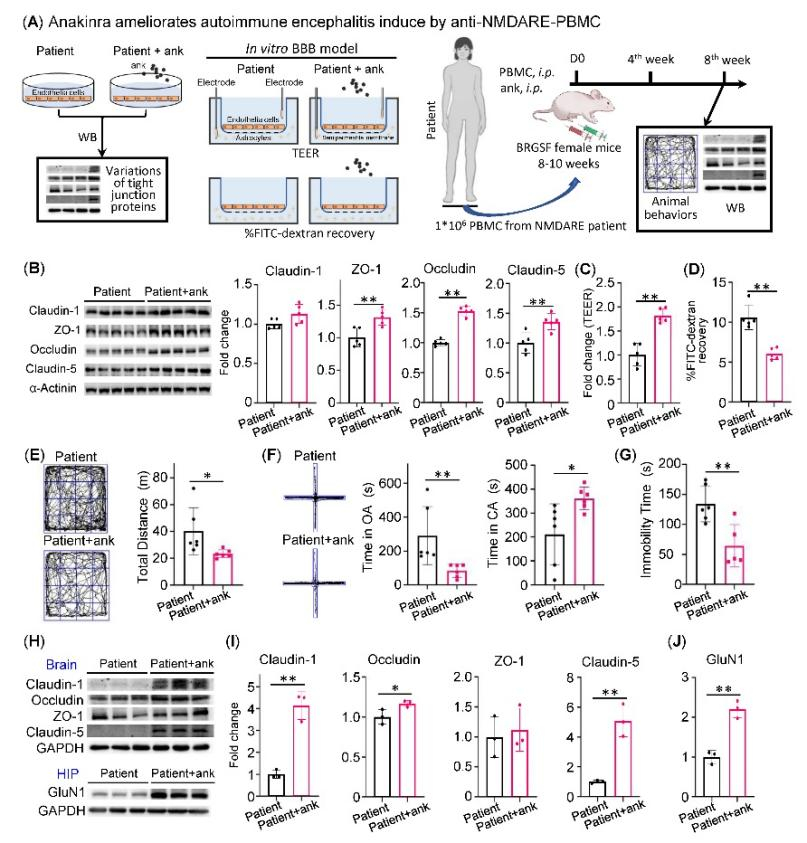
图5
本研究首次构建了PBMC诱导的人源化抗NMDAR脑炎小鼠模型,并进一步从体内、体外实验揭示PBMC通过上调IL-1β促进BBB的破坏进而诱导模型小鼠脑炎发生。该研究不仅阐明了抗NMDAR脑炎潜在的发病机制,也为抗NMDAR脑炎的精准治疗提供了新的靶点,并为下一步开展Anakinra药物临床试验奠定了理论基础。
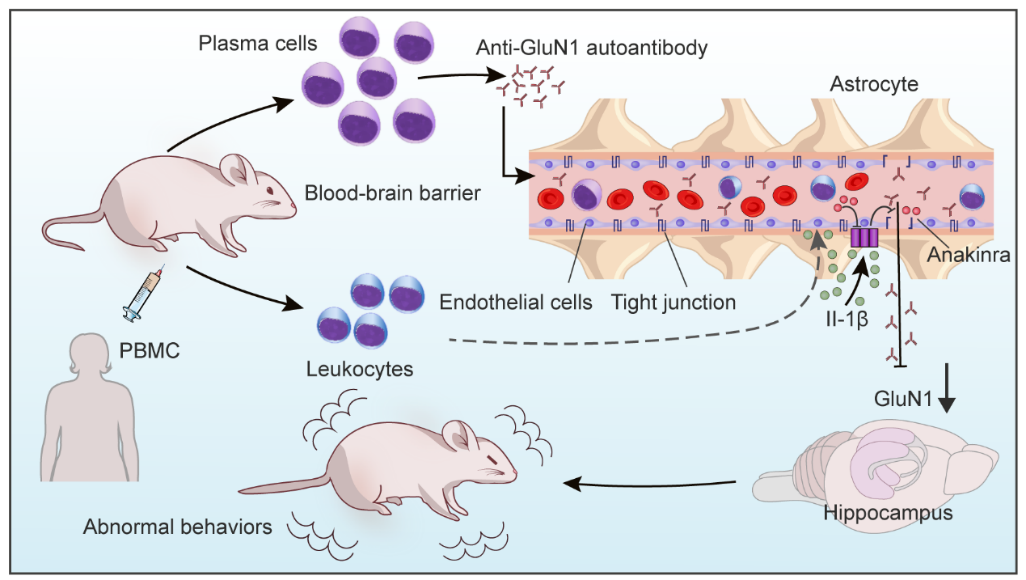
图6:研究首次构建了PBMC诱导的人源化抗NMDAR脑炎小鼠模型,并进一步从体内、体外实验揭示PBMC通过上调IL-1β促进BBB的破坏进而诱导模型小鼠脑炎发生
近年来,邱伟、舒崖清课题组一直致力抗NMDAR脑炎等自身免疫脑炎的临床与基础研究,从疾病的遗传病因学、临床标记物等多个角度进行了深入探讨,取得了一系列成果。课题组于2019年首次发现中国抗NMDAR脑炎患者的易感基因HLA_DRB1*16:02,相应成果发表在国际知名杂志JNNP杂志上(Journal of Neurology, Neurosurgery, and Psychiatry. 2019)。此外,课题组还发现IRF7,BANK1,TBX21等多个易感基因(European Journal of Neurology. 2021)。课题组还系统地研究了抗NMDAR脑炎的生物标志物在临床上的作用,包括焦亡关键蛋白Gasdermin D (Journal of Neurochemistry. 2021)、神经纤维丝轻链(Journal of Neurochemistry.2023;Neurological Sciences. 2022)、CD40/CD40L(Journal of Neuroimmunology.2022)、胱抑素C(Journal of Neuroimmunology. 2022;Acta Neurologica Scandinavica. 2018)、补体(European Journal of Neurology. 2018)等,上述生物标志物与病情严重程度、治疗反应等相关,成为临床上评估患者病情的指标。
未来,脑病中心神经免疫团队将继续加强与中国科学院精密测量科学与技术创新研究院王杰、香港中文大学刘晓东等国内外科研机构研究者的合作与交流,促进神经免疫亚专科的科研达到国内领先、国际一流水平。
原文链接:https://doi.org/10.1186/s12974-023-02844-4






