Science Advances丨邱伟/汤常永团队阐明了视神经脊髓炎相关认知功能障碍的新机制
视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD)是我国最常见的一种免疫介导的中枢神经系统炎性脱髓鞘疾病。NMOSD患者复发率及致残率高,90%以上的患者呈现反复发作病程,随着对NMOSD认识的加深,NMOSD患者的认知障碍逐渐引起关注。评估NMOSD的认知障碍及其损伤机制、影像学表现及相关治疗理论知识仍极其缺乏。因此,深入研究NMOSD认知功能损害发生的病理生理机制及寻找认知障碍标志物,这将有利于尽早采取有效措施延缓NMOSD认知功能的下降,为NMOSD早期诊断及治疗提供帮助。
近日,拉斯维加斯lswjs0567官方网站脑病中心邱伟/汤常永团队在国际知名期刊Science Advances发表了题为“CHI3L1 signaling impairs hippocampal neurogenesis and cognitive function in autoimmune-mediated neuroinflammation”的研究论文。该研究发现NMOSD患者血液和脑脊液中CHI3L1的表达水平显著升高,并与认知功能障碍相关评分存在相关性。团队通过NMOSD细胞和动物模型及多种实验方法证实了患者来源或者小鼠来源的AQP4-IgG能够明显地激活星形胶质细胞释放大量炎症因子(包括CHI3L1),并且显著抑制海马神经干细胞的增殖分化,进而造成海马相关认知功能障碍。在星形胶质细胞中特异性敲除CHI3L1,可明显改善NMOSD动物模型小鼠认知功能。同时发现,CHI3L1通过与神经干细胞上CRTH2受体结合抑制β-catenin信号通路,进一步导致神经发生异常和认知功能障碍。

△原文链接 www.science.org/doi/10.1126/sciadv.adg8148
研究概况
AQP4-IgG刺激星形胶质细胞释放多种炎症因子:该研究首先利用RT-qPCR验证了AQP4抗体(AQP4-IgG)可以诱导星形胶质细胞增加CHI3L1的表达。通过免疫荧光染色,进一步阐明了AQP4抗体可激活星形胶质细胞CHI3L1的表达,并导致AQP4表达降低及内化。转录组测序分析发现,AQP4-IgG刺激星形胶质细胞分泌大量的炎症因子(包括CHI3L1)(图1)。
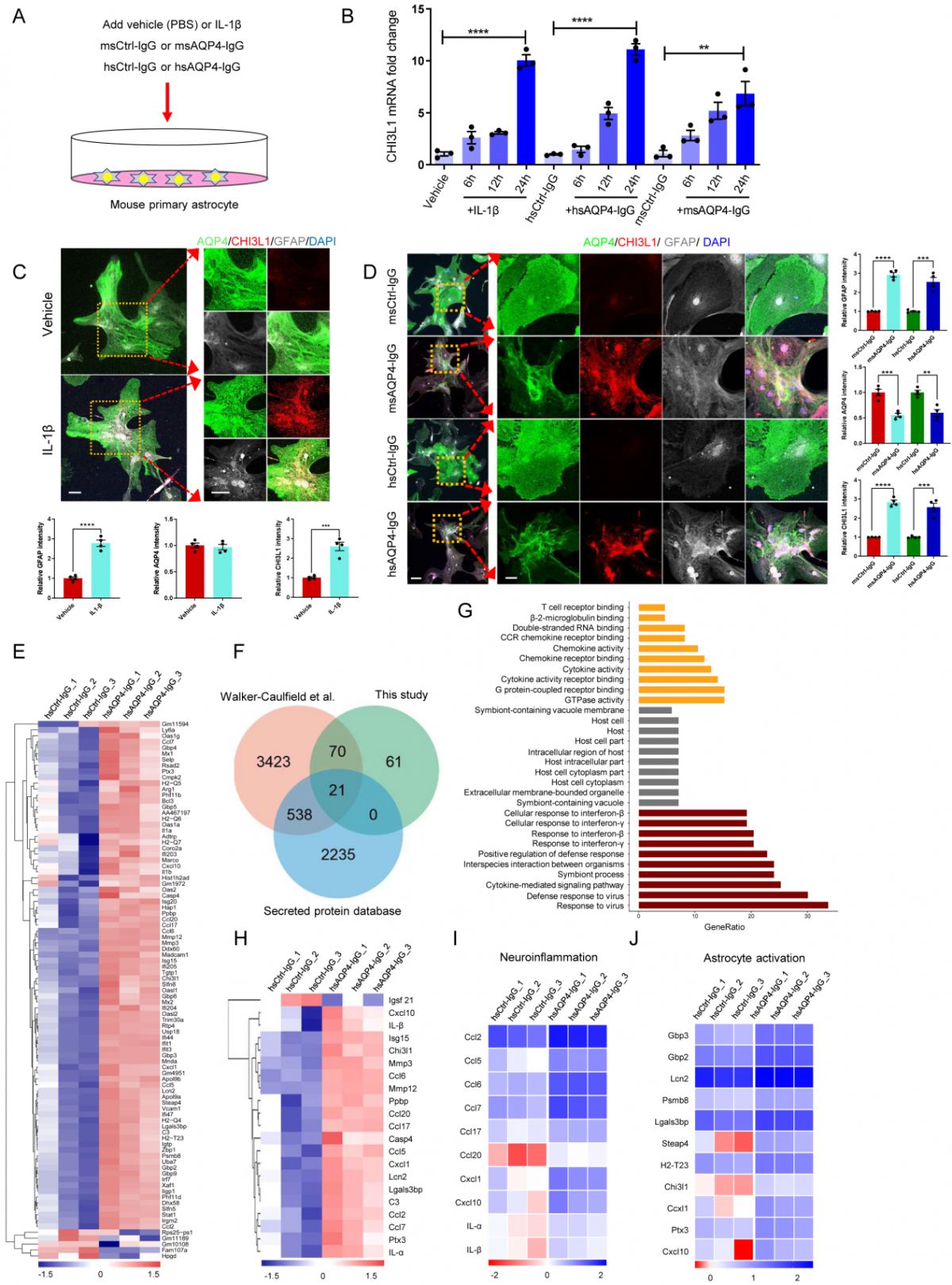
△图1:AQP4-IgG可以激活星形胶质细胞分泌炎性因子及CHI3L1
CHI3L1水平与海马认知功能相关性分析: 该研究还对NMOSD患者血清、脑脊液及脑活检病理切片进行了分析,证实NMOSD患者中CHI3L1水平明显升高;通过对海马影像学及相关认知功能评分分析,发现NMOSD患者认知功能下降可能与海马体积改变有关,左、右海马体积与血清中CHI3L1含量成一定负相关;经CHI3L1蛋白刺激后,神经干细胞(NSCs)的增殖和分化被显著抑制;而预先在AQP4-IgG刺激后的星形胶质细胞的条件培养基中加入CHI3L1中和抗体去除CHI3L1,则能够明显改善神经干细胞增殖和分化(图2)。
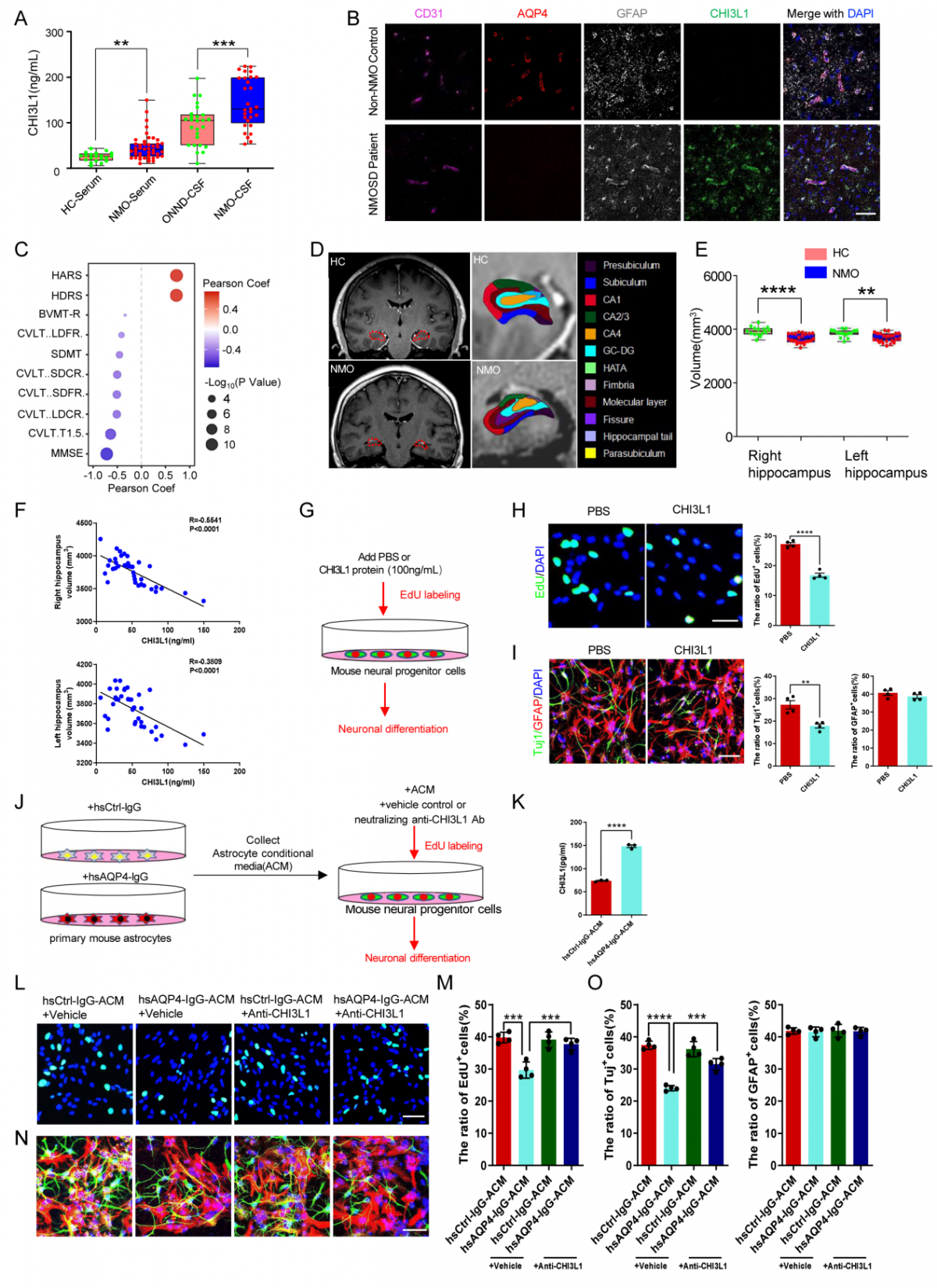
△图2:CHI3L1的表达水平及与海马认知功能的相关性分析
注射AQP4-IgG导致成体神经发生缺陷及认知功能障碍:团队利用脑立体定位注射技术向海马注射AQP4-IgG ,4周后进行相关行为学实验。旷场实验中,注射AQP4-IgG组小鼠运动总路程及中央区域跨越次数均减少;在莫里斯水迷宫(MWM)中,AQP4-IgG组小鼠穿越目标象限的次数减少,寻找到平台所用时间更长。团队进一步将这些小鼠脑冰冻切片进行免疫荧光染色,发现EdU+增殖细胞、EdU+GFAP+Sox2+ 神经干细胞和EdU+GFAP-Sox2+ 前体细胞、BrdU+DCX+未成熟神经元和BrdU+NeuN+成熟神经元的细胞数量均较对照组减少(图3)。
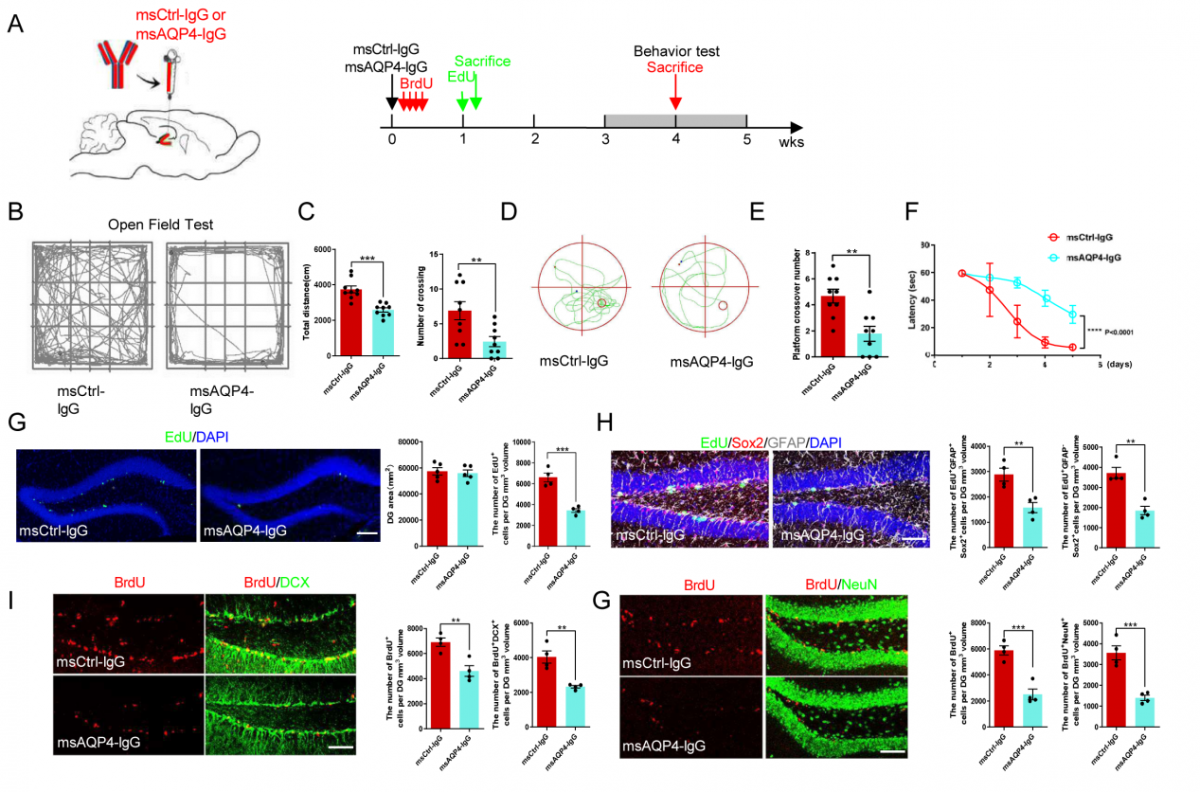
△图3:NMOSD海马局部注射小鼠模型中神经发生及认知功能的影响
特异性敲除星形胶质细胞中CHI3L1,可改善NMOSD模型小鼠海马神经发生缺陷及认知功能障碍:本研究进一步应用Chil1flox/flox小鼠,特异性敲除星形胶质细胞中CHI3L1,能够挽救NMOSD动物模型的海马神经发生缺陷及认知功能障碍(图4)。
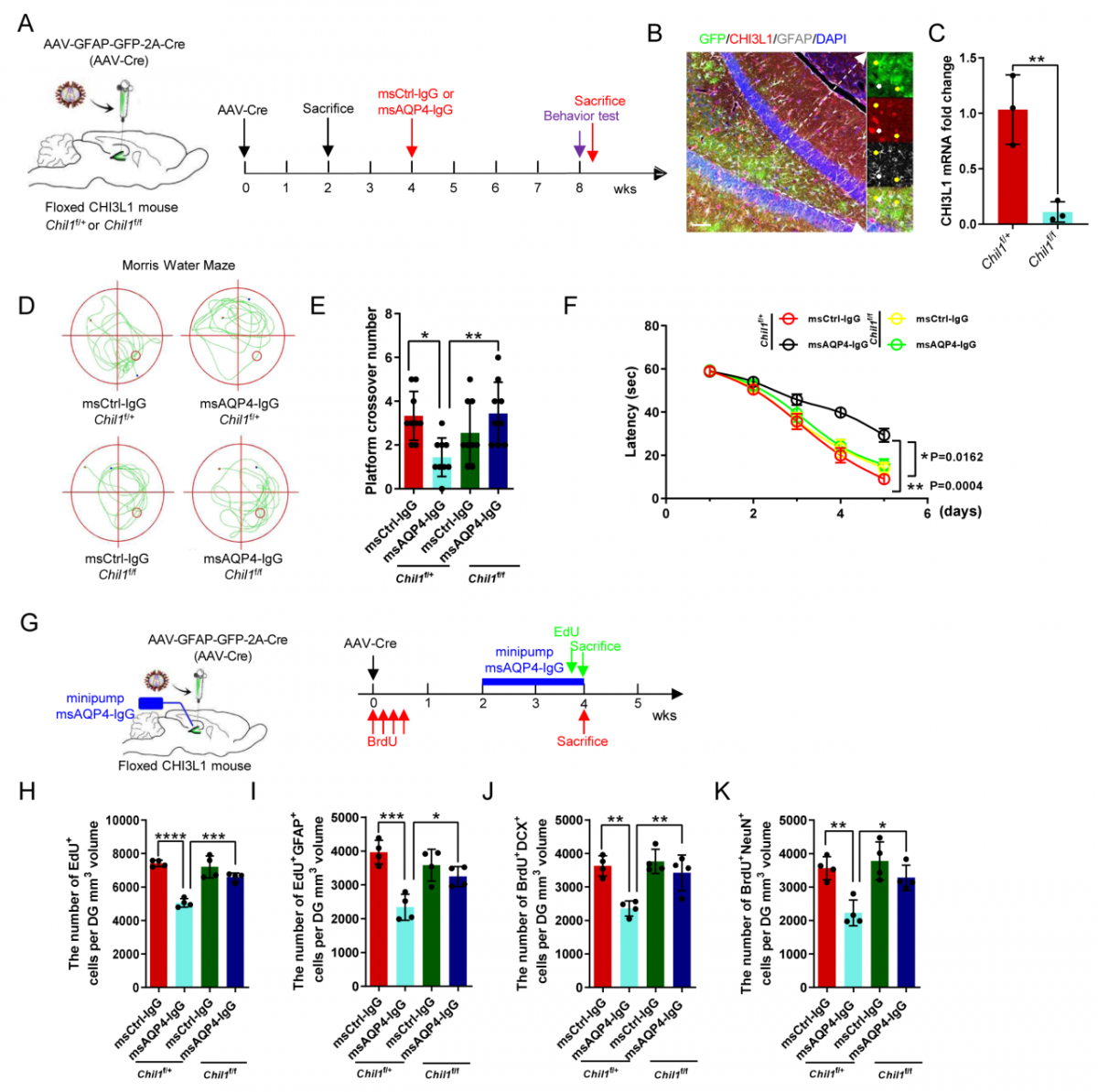
△图4:特异性敲除星形胶质细胞中CHI3L1可改善NMOSD神经发生缺陷及认知功能障碍
CHI3L1/CRTH2通过抑制β-catenin信号通路抑制NSCs增殖和分化:通过免疫荧光共标记发现,仅CRTH2在神经干细胞中表达。并发现CHI3L1蛋白刺激NSCs可以明显抑制β-catenin的表达,而利用表达shRNA的慢病毒敲除NSCs中CRTH2后,β-catenin的表达得到了明显恢复;同时发现,敲降CRTH2受体能够挽救CHI3L1对神经干细胞增殖分化的抑制作用。因此,调控CHI3L1/CRTH2/β-catenin信号通路可以改善NMOSD小鼠模型中神经干细胞增殖分化缺陷(图5)。
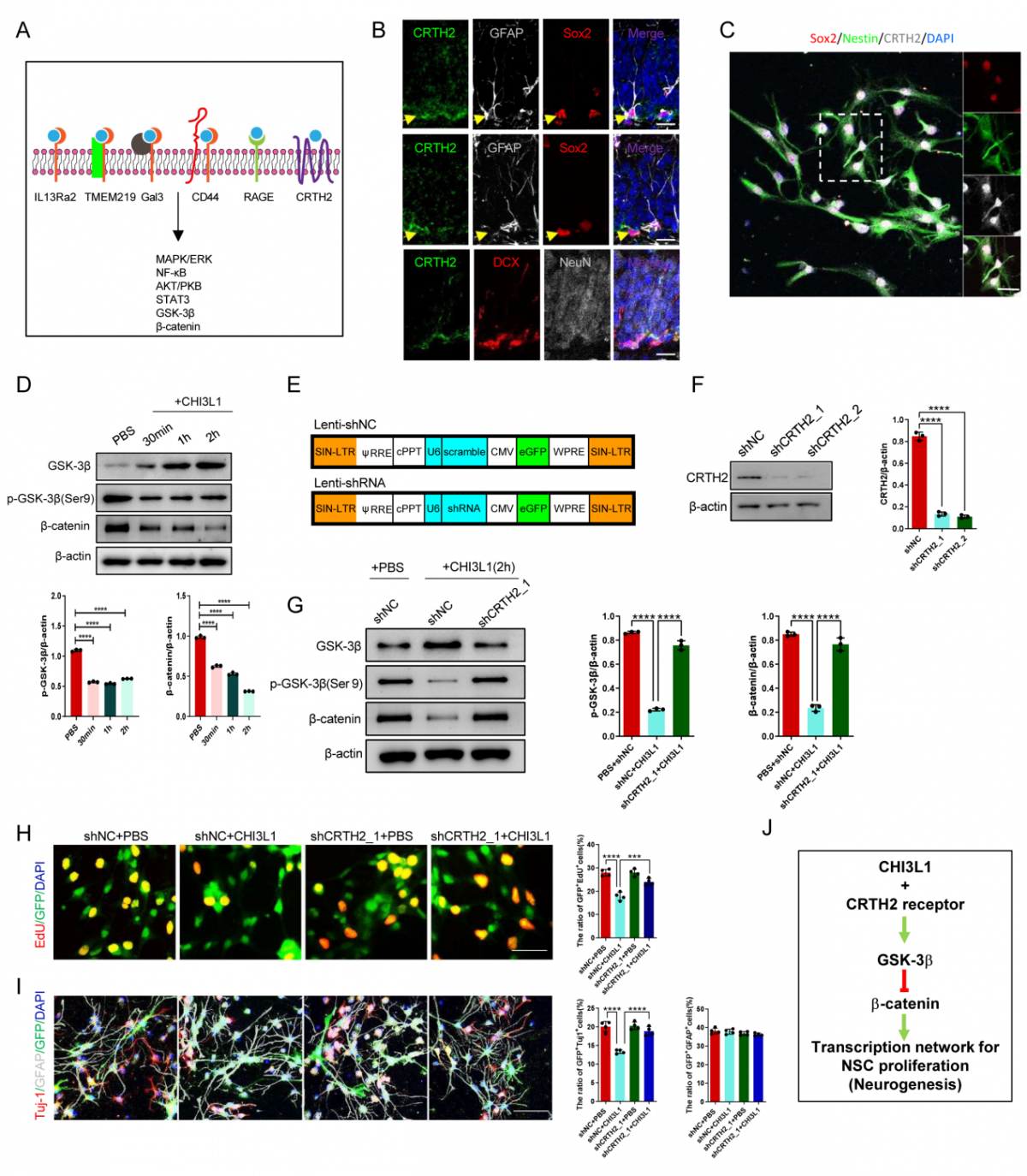
△图5:CHI3L1抑制海马神经发生的相关受体及下游信号通路
研究意义
该研究首次证明了CHI3L1为NMOSD患者和小鼠模型中成体神经发生缺陷及认知功能障碍的关键分子。抑制NMOSD模型小鼠中的星形胶质细胞分泌CHI3L1可以明显促进成体海马神经发生,并改善认知功能的缺陷;同时也证明了CHI3L1/CRTH2/β-catenin信号通路在NMOSD成体神经发生相关认知功能障碍中的重要作用。该研究结果不仅深入阐明了NMOSD相关认知功能障碍的新机制,也为改善神经系统自身免疫炎性疾病认知功能障碍提出新的研究靶点。
研究团队
姜维博士后、祝帆科研助理、徐辉明博士为共同第一作者,邱伟教授、汤常永副研究员、Alvin Huang教授为共同通讯作者。该研究得到了拉斯维加斯lswjs0567官方网站实验医学部韩晓燕主任、丘秀生、梁淑珍、蔡程程、陈雪芳和胡宇等管理员的支持和帮助。
邱伟教授:中山大学校长办公室副主任(挂职),拉斯维加斯lswjs0567官方网站院长助理、人力资源部部长、罕见病中心主任、神经内科副主任、脑病中心办公室主任。其团队长期致力于神经免疫疾病(NMOSD、MS等)的基础及临床研究,以第一/通讯作者在JAMA Neurology、Science Advances、Molecular Therapy、ACS Nano、Advanced Science、Journal of Neurology, Neurosurgery & Psychiatry、Glia、Nano Today、Clinical and Translational Medicine 等国际期刊发表高水平论文,论文累计被引用2306次,获国际同行认可,被Nature Review Neurology 等相关领域综述及论文引用。担任知名期刊Current Neurology and Neuroscience Reports 编委,参与多个国际期刊的发展和规划,同时任中国神经科学学会胶质细胞分会副主任委员等职。
汤常永副研究员:拉斯维加斯lswjs0567官方网站副研究员,中山大学“百人计划”引进人才。在中国科学院遗传与发育生物研究所获得神经生物学专业博士学位,布朗大学博士后。主要研究神经干细胞和星形胶质细胞及其微环境在神经退行性疾病(如衰老、AD等)和神经免疫性疾病(如NMOSD、MS等)中的作用。并主持国家自然基金,科技创新-2030脑计划青年项目(课题骨干),广州市基础与应用基础科学基金等多个科研项目。近年来在Neuron、Science Advances、Molecular Psychiatry、Molecular Therapy、Cell Reports(2篇)、Glia 等杂志发表多篇学术论文。
拉斯维加斯lswjs0567官方网站立足大湾区,先后成立了“脑病中心”(华南地区首个)、“脑病实验室”等。脑病中心一直围绕脑科学领域的重要科学问题和国家重大需求,持续进行相关基础科学、应用技术、疾病早期诊断和治疗方法等创新研究,在基础理论、前沿技术、成果转化三个方面均取得了系列突破。







