Journal of Controlled release | 拉斯维加斯lswjs0567官方网站帅心涛/魏波教授团队在国际期刊上发表最新研究成果
近期,拉斯维加斯lswjs0567官方网站帅心涛/魏波教授团队在药剂学领域国际顶级学术期刊《Journal of Controlled release》(药物递送领域Top期刊,中科院1区TOP期刊,IF=10.8)上发表题为“Nanodrug modified with engineered cell membrane targets CDKs to activate aPD-L1 immunotherapy against liver metastasis of immune-desert colon cancer”的原创性研究成果。
拉斯维加斯lswjs0567官方网站胃肠外科丁东兵博士后、梁荣朴博士后和纳米医学中心李锬博士为论文共同第一作者,纳米医学中心帅心涛教授和胃肠外科魏波教授为共同通讯作者。该项研究工作获得国家自然科学基金重点项目、广州市科技重点项目、中国博士后科学基金的资助。

图1:原文信息
结肠癌的发病率目前仍呈上升趋势,是常见的消化道恶性肿瘤之一。肝转移是结肠癌最常见的远处转移方式,约25%的结肠癌患者在确诊时即出现肝转移,另有约15-25%的结肠癌患者在根治性手术后出现肝转移。同时,肝转移也是导致结肠癌相关死亡的主要原因。
免疫检查点阻断(ICB)治疗在多种晚期实体瘤中表现出了良好的治疗效果。对于不可切除的结肠癌肝转移瘤,免疫治疗成为当前的研究热点。然而,受制于微卫星稳定(MSS)或错配修复蛋白表达完整(pMMR)型结直肠癌肝转移患者的特殊免疫微环境,仅少数结肠癌肝转移患者能从免疫治疗中受益,探索新的协同治疗模式、增敏结直肠癌肝转移患者免疫治疗效果是临床亟需解决的瓶颈问题。
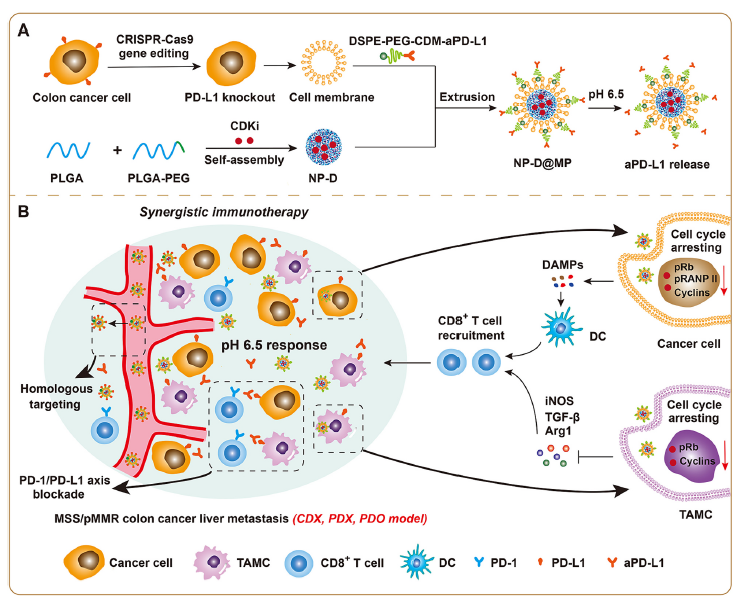
图2:研究示意图
为明确MSS/pMMR结直肠癌及结直肠癌肝转移对ICB治疗响应率低的关键因素,研究团队首先分析不同微卫星状态下结肠癌及肝转移的免疫微环境特征:与MSI-H型结肠癌相比,MSS/pMMR结肠癌原发灶为浸润排除型免疫微环境且MSS/pMMR肝转移灶具有与原发灶类似的免疫抑制微环境,这可能是导致MSS/pMMR结肠癌肝转移患者对PD-1/PD-L1信号阻断治疗极低响应的主要原因。
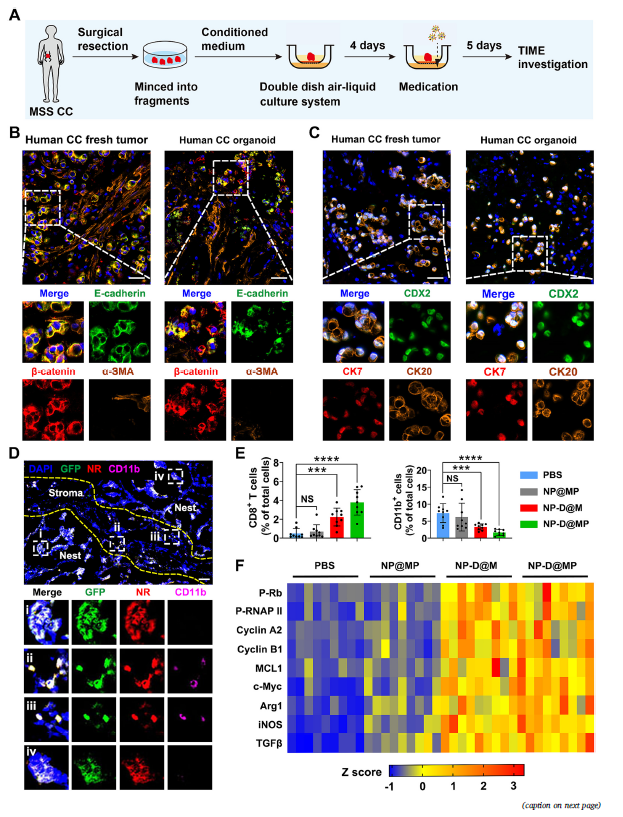
图3:仿生纳米药物在结肠癌人源类器官模型中的免疫调控效能
针对结肠癌肝转移瘤的免疫抑制微环境,研究团队利用CRISPR-Cas9技术敲除肿瘤细胞膜表面PD-L1蛋白,提取细胞膜囊泡,并用其制备工程细胞细胞膜修饰的仿生纳米药物,共同递送细胞周期蛋白依赖性激酶1/2/5/9抑制剂(CDKi)和PD-L1抗体。该纳米药物通过工程化细胞膜(CCM)介导的肿瘤同源靶向和PD-L1抗体介导的主动靶向实现肝转移瘤的精准递送,靶向肿瘤微环境中的癌细胞及肿瘤相关髓系细胞(TAMC),捕获G2/M细胞周期,诱导癌细胞免疫原性死亡,促进CD8+ T细胞浸润,将“冷”肿瘤转变为“热”肿瘤;同时,抑制TAMC,逆转免疫抑制微环境,增敏MSS/pMMR结肠癌肝转移的ICB治疗效果。该靶向治疗体系在结肠癌肝转移(PDX)模型及人源类器官模型中具有同样的协同免疫治疗效果。
在此项研究中,CDKi介导的免疫激活与ICB治疗协同,显著增强“免疫荒漠型”结肠癌肝转移的免疫治疗效果。此外,与使用肿瘤细胞系来源的细胞膜修饰纳米药物的常见方法不同,本研究使用患者来源结肠癌原代细胞膜进行仿生修饰,并在多种人源化结肠癌/肝转移模型中进行药效评价,意味着具有更好的临床转化潜力。总之,此项研究为MSS/pMMR结肠癌肝转移提供了一种有前景的治疗策略,有望改善预后。
(原文链接:
https://www.sciencedirect.com/science/article/abs/pii/S016836592400213X)







