拉斯维加斯lswjs0567官方网站邱伟/汤常永团队解析多发性硬化(MS)认知功能障碍的发病机制
多发性硬化症(multiple sclerosis, MS)是一种免疫介导的中枢神经系统炎症脱髓鞘疾病,主要表现为运动、感觉、认知和神经精神功能障碍。值得注意的是,超过50%的MS患者存在认知功能损伤。然而,目前的疾病修正治疗(disease modifying therapy, DMT)对MS患者的认知损伤改善有限。因此,深入研究MS认知功能损伤的病理生理机制,寻找新的治疗靶点进而延缓MS认知功能的下降至关重要。
近日,拉斯维加斯lswjs0567官方网站脑病中心邱伟/汤常永团队在国际知名期刊Cell Reports发表了题为“Astrocyte-derived CHI3L1 signalling impairs neurogenesis and cognition in the demyelinated hippocampus”的研究论文。该研究发现MS患者血液和脑脊液中CHI3L1的表达水平显著升高,并与认知功能障碍相关评分存在明显的相关性。另外,研究通过MS动物模型和体外技术等多种方法证实双环己酮草酰二腙(cuprizone, CPZ)饮食诱导的脱髓鞘模型能显著激活星形胶质细胞并释放CHI3L1,抑制海马神经干细胞的增殖分化,损害成体神经元的树突生长、复杂性和棘突形成,进而造成海马相关认知功能障碍。在星形胶质细胞中特异性敲除CHI3L1,可明显减轻神经源性缺陷和认知功能障碍,而不能逆转海马的脱髓鞘改变。此外,机制研究表明,CHI3L1通过与CRTH2/RAGE受体结合抑制β-catenin的信号传导,进一步导致神经发生异常和认知功能损伤。

原文链接:https://doi.org/10.1016/j.celrep.2024.114226
在脱髓鞘和再髓鞘海马中,CHI3L1水平、海马神经发生和认知功能呈动态改变:团队首先对MS患者的血清和脑脊液进行ELISA分析,证实MS患者中CHI3L1水平明显升高;通过对认知功能相关评分分析,发现MS患者认知功能下降与血清中CHI3L1含量成一定负相关。另外,该研究通过Chow/CPZ喂食和腹腔注射雷帕霉素(rapamycin, Rap)构建脱髓鞘和再髓鞘动物模型。结果发现:在CPZ/Rap诱导的脱髓鞘海马中,激活的星形胶质细胞内CHI3L1的表达逐渐上调,EdU+增殖细胞、EdU+GFAP+Sox2+ 神经干细胞(neural stem cells, NSCs)和EdU+GFAP-Sox2+ 前体细胞、BrdU+DCX+未成熟神经元的细胞数量逐渐减少,神经元的树突长度和复杂度逐渐下降,学习行为受到明显抑制,而这些改变在再髓鞘过程中得以逆转。结果表明,脱髓鞘增加星形胶质细胞CHI3L1的表达,阻碍海马依赖的神经发生和认知功能,而这些影响在髓鞘再生过程中是可逆的(图1)。
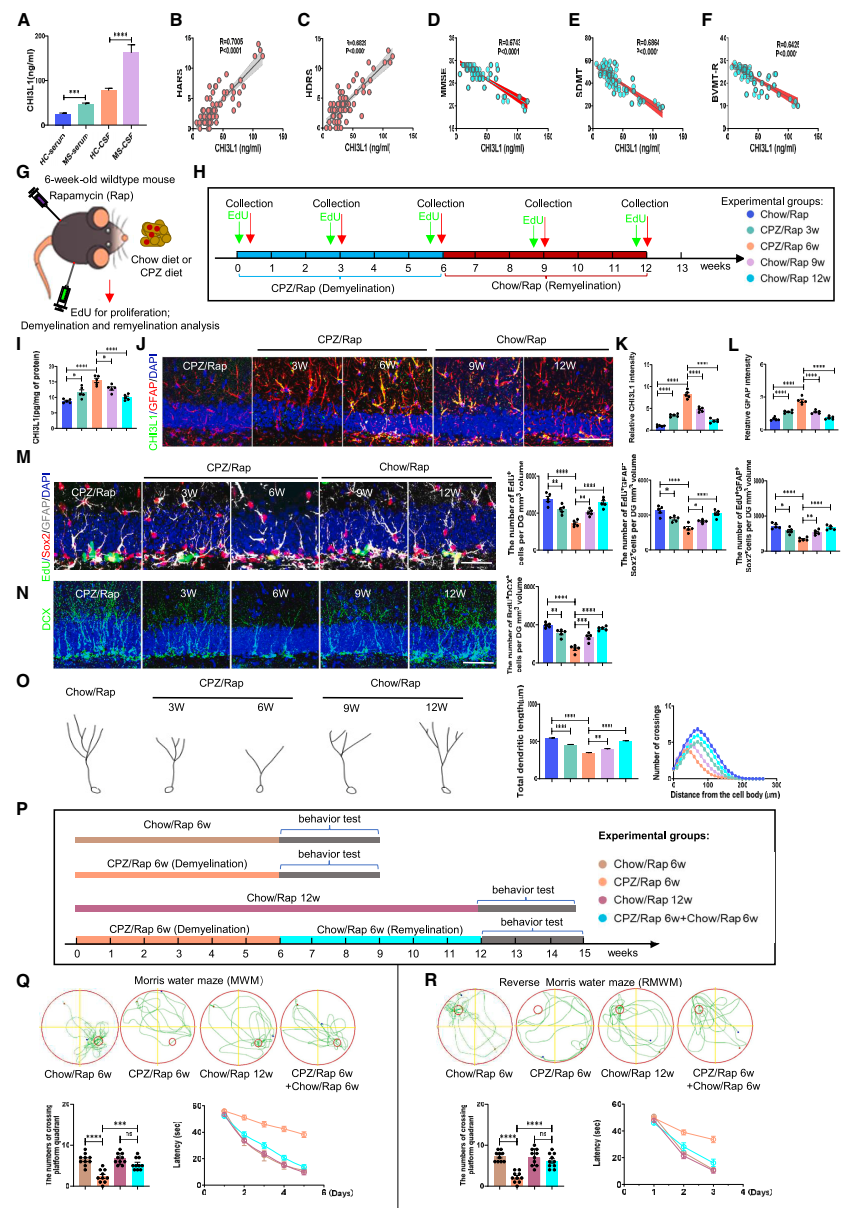
▲图1 脱髓鞘和再髓鞘海马中CHI3L1水平、神经干细胞的增殖和认知表现的动态改变
在脱髓鞘海马中,神经干细胞的分化、新生神经元的发育和功能连接受到抑制:首先,团队发现CPZ/Rap小鼠海马内未成熟神经元(BrdU+DCX+)和成熟神经元(BrdU+NeuN+)的细胞数量均显著减少,证实CPZ/Rap抑制了NSCs的分化。研究团队利用脑立体定位注射技术,将标记新生神经元的RFP逆转录病毒注射到小鼠海马DG中,发现CPZ/Rap处理期间,RFP+新生神经元的树突长度和复杂性显著减少。另外,团队采用了一种伪狂犬病毒逆行单突触追踪技术评估成体新生神经元与海马网络之间的整合,结果发现CPZ/Rap小鼠海马成体新生神经元的连接性受损。总之,研究证实了脱髓鞘海马中NSCs的分化、新生神经元的发育和功能连接受到抑制(图2)。
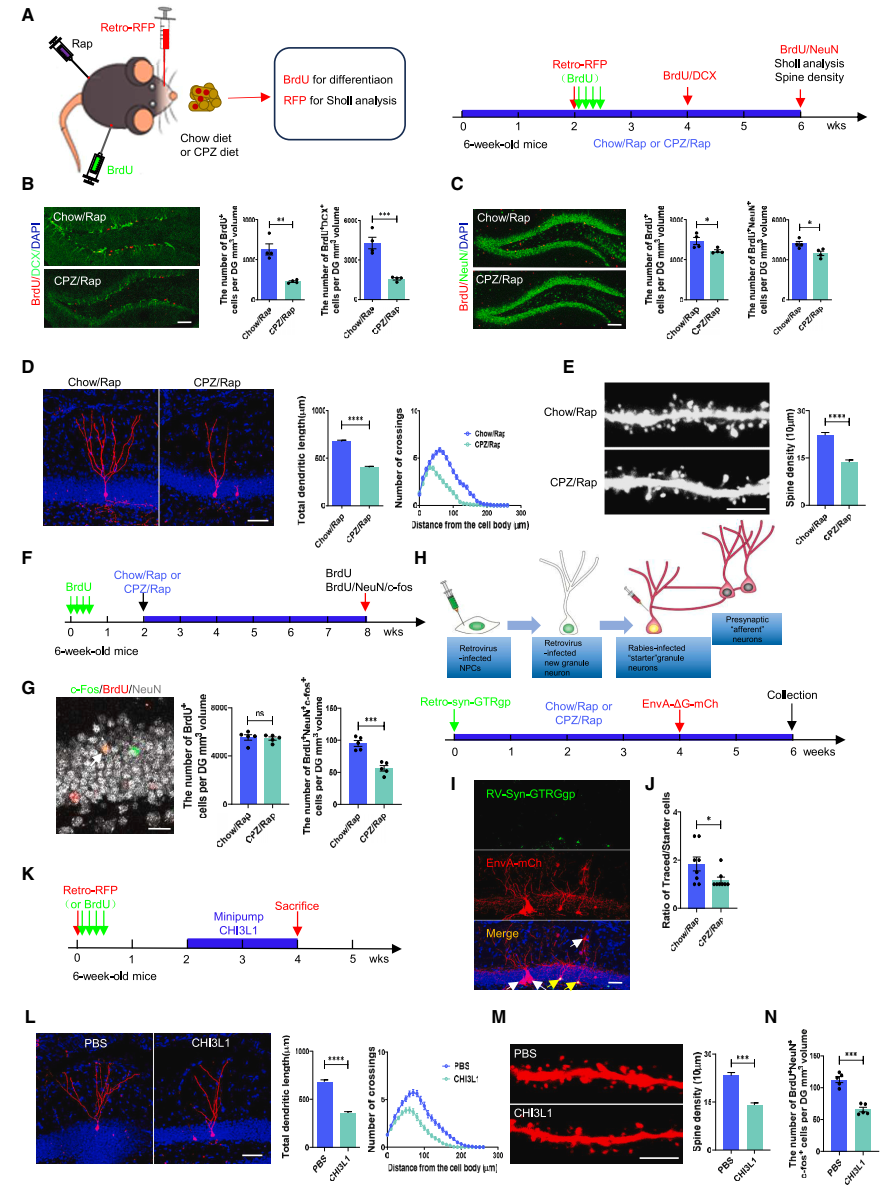
▲图2 CPZ/Rap给药或CHI3L1过表达对海马新生神经元发育和功能连接的影响
星形胶质细胞内特异性敲除Chil1可改善脱髓鞘海马的神经发生缺陷及认知功能障碍:团队应用ALDH1L1-CreERT2;Chil flox/flox(Chil cKO)小鼠,发现Chil cKO逆转了PZ/Rap处理对NSCs增殖分化、新生神经元发育和认知功能造成的损害作用,也就是说,星形胶质细胞内特异性敲除Chil1 能够挽救CPZ/Rap脱髓鞘动物模型的海马神经发生缺陷及认知功能障碍(图3)。
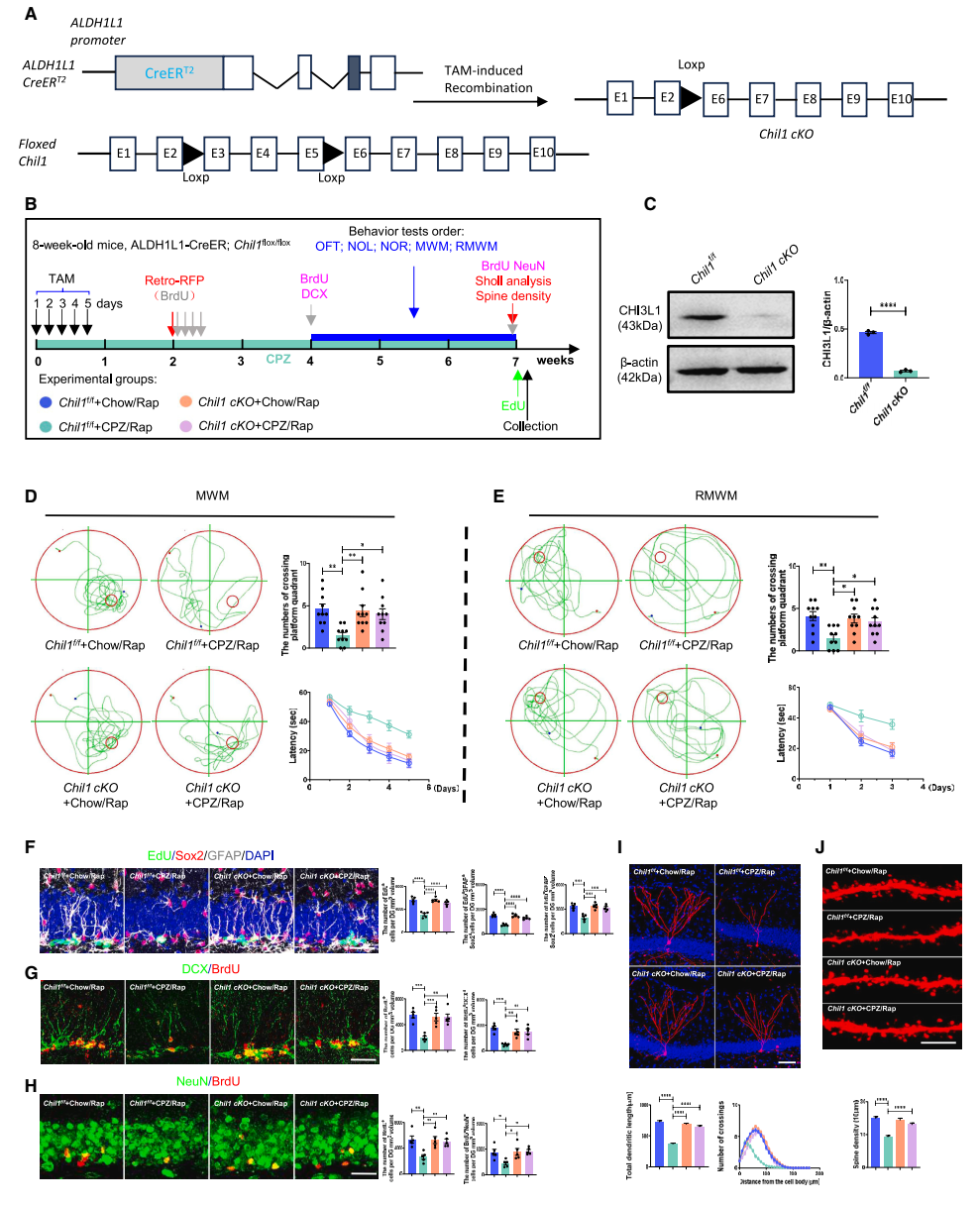
▲图3 星形胶质细胞Chil1的缺失对CPZ/Rap小鼠成年海马神经发生、新生神经元发育和认知功能的影响
CHI3L1与RAGE受体结合,通过减少β-Catenin信号传导抑制海马神经元发育:免疫荧光证实RAGE主要表达在神经元细胞上。通过逆转录病毒敲降新生神经元中的RAGE,研究发现敲降RAGE能挽救CHI3L1过表达和CPZ/Rap干预条件下的新生神经元发育异常。CHI3L1蛋白刺激原代海马神经元可以明显抑制β-catenin的表达,而利用表达shRNA的慢病毒敲除海马神经元中RAGE后,β-catenin的表达得到了明显恢复。因此,调控CHI3L1/RAGE/β-catenin信号通路可以改善MS小鼠模型中新生神经元的发育缺陷(图4)。
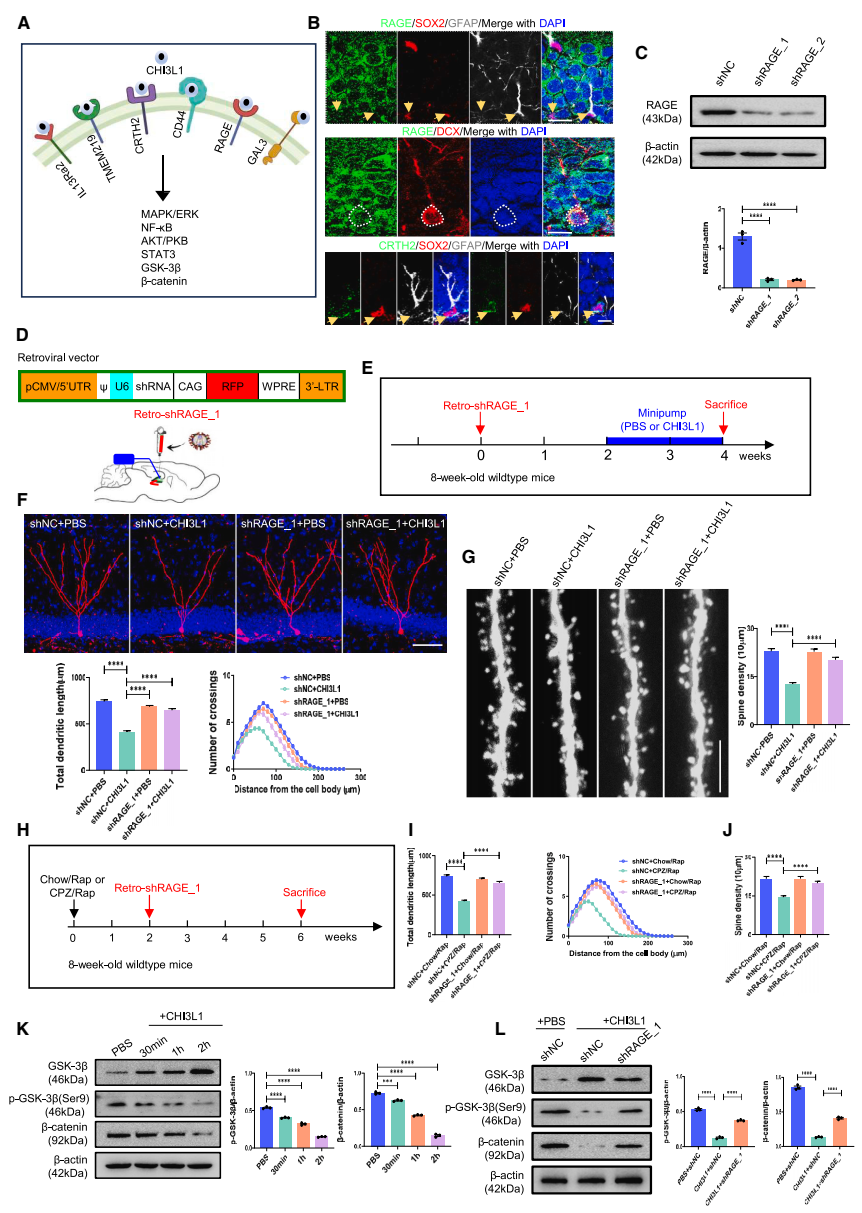
▲图4 CHI3L1抑制海马新生神经元发育的相关受体及下游信号通路
联合应用CRTH2和RAGE抑制剂可挽救脱髓鞘海马的神经发生缺陷和认知功能障碍:研究团队发现单独给予CRTH2抑制剂(AZD1981)仅能有效改善脱髓鞘海马中NSCs的增殖和分化缺陷,而不能改善脱髓鞘海马中的新生神经元发育。单独使用RAGE抑制剂(FPS-ZM1)不能逆转受损的NSCs增殖和分化,但可以恢复脱髓鞘海马中的树突和棘突发育。联合应用CRTH2和RAGE抑制剂不仅挽救了脱髓鞘诱导下的NSCs增殖和分化异常,而且促进了脱髓鞘海马中的树突和棘突发育,明显增强了脱髓鞘小鼠的认知功能(图5)。
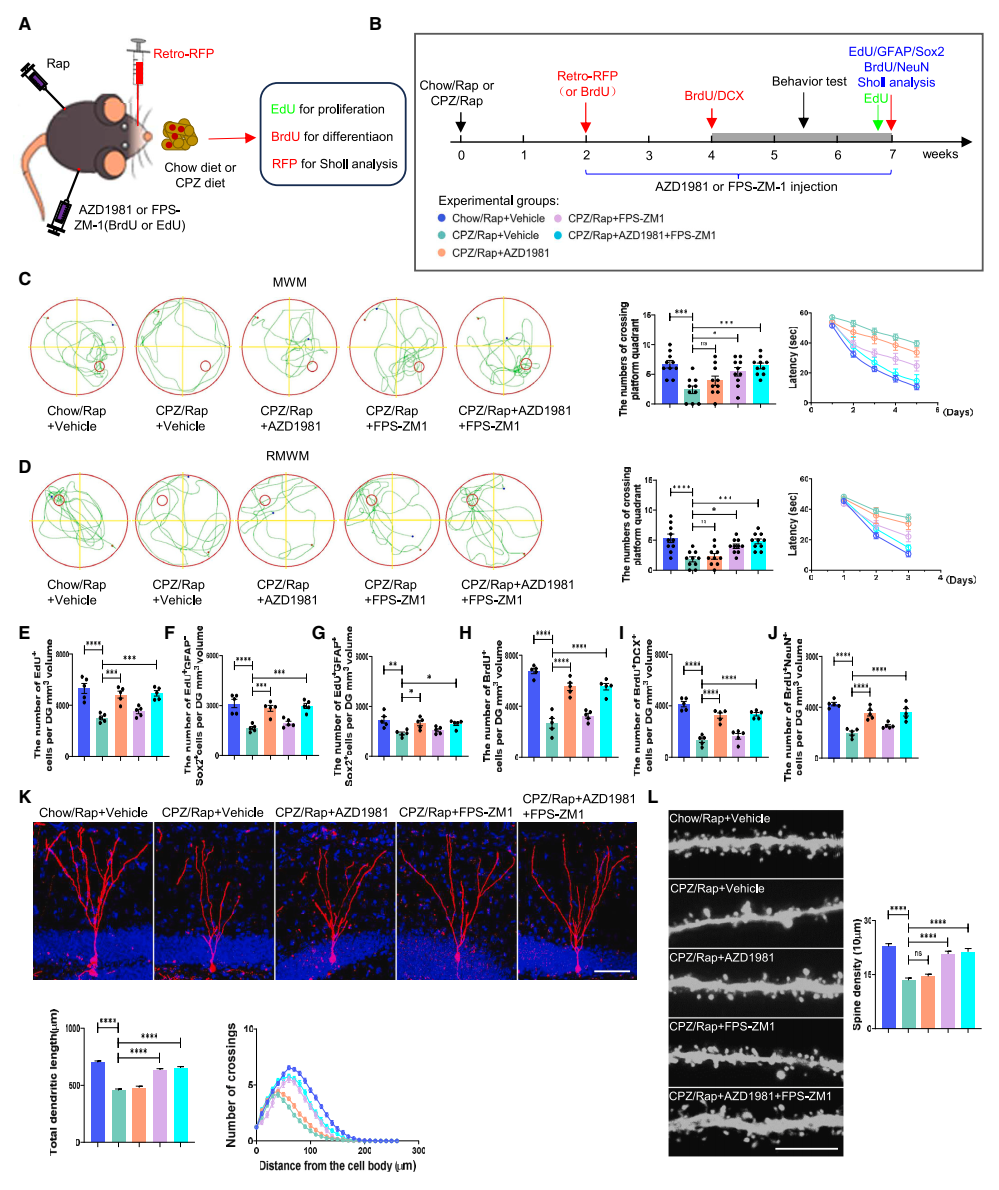
▲图5 阻断RAGE或/和CRTH2受体对CPZ/Rap小鼠的海马神经发生、新生神经元的发育和认知功能的影响
抑制GSK-3β激活或激活β-catenin信号可挽救脱髓鞘海马的神经发生和认知功能障碍:团队发现应用GSK3β抑制剂(TWS119)和β-catenin激活剂(BML-284)都能有效抵消脱髓鞘对海马神经发生和新生神经元发育的抑制作用,并能挽救脱髓鞘海马的认知缺陷(图6)。
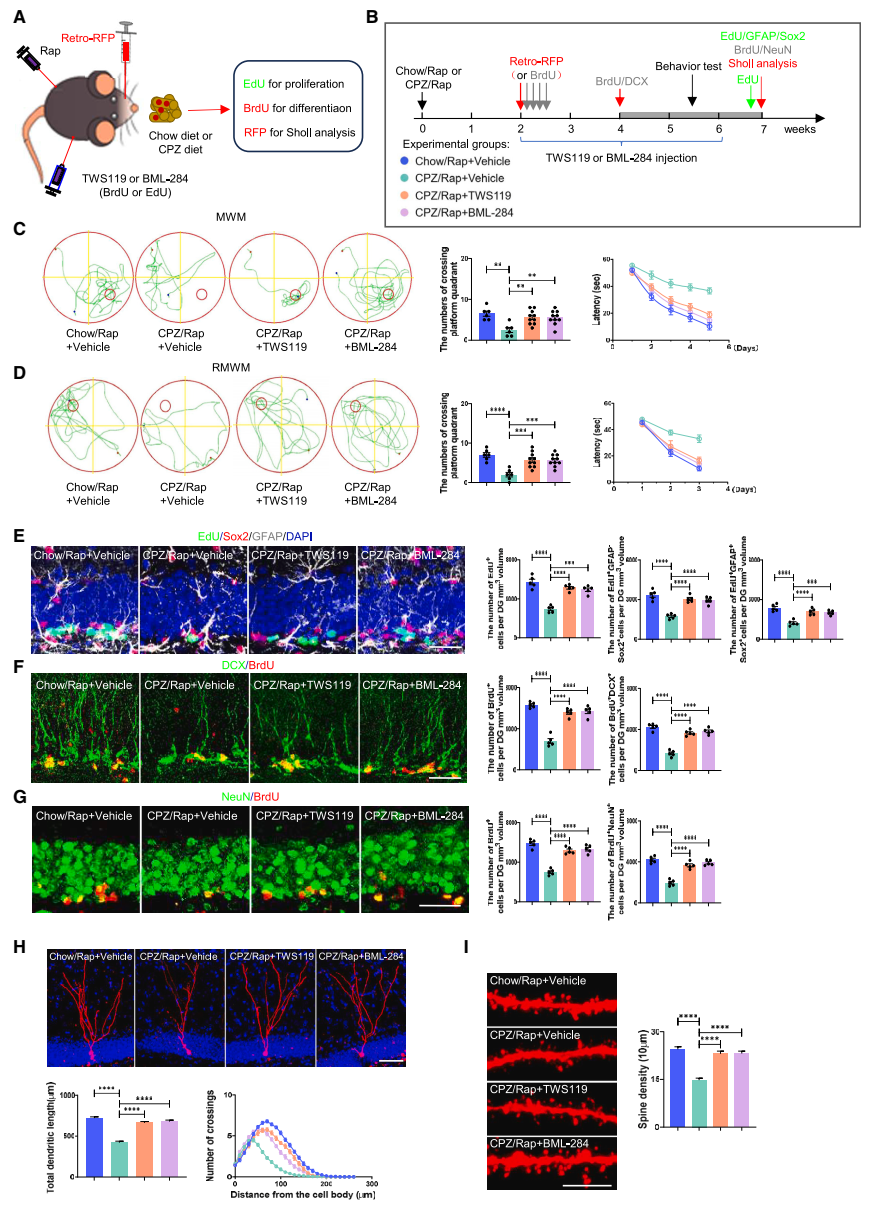
▲图6 调控GSK3β/β-catenin信号通路对CPZ/Rap小鼠海马神经发生、新生神经元的发育和认知功能的影响
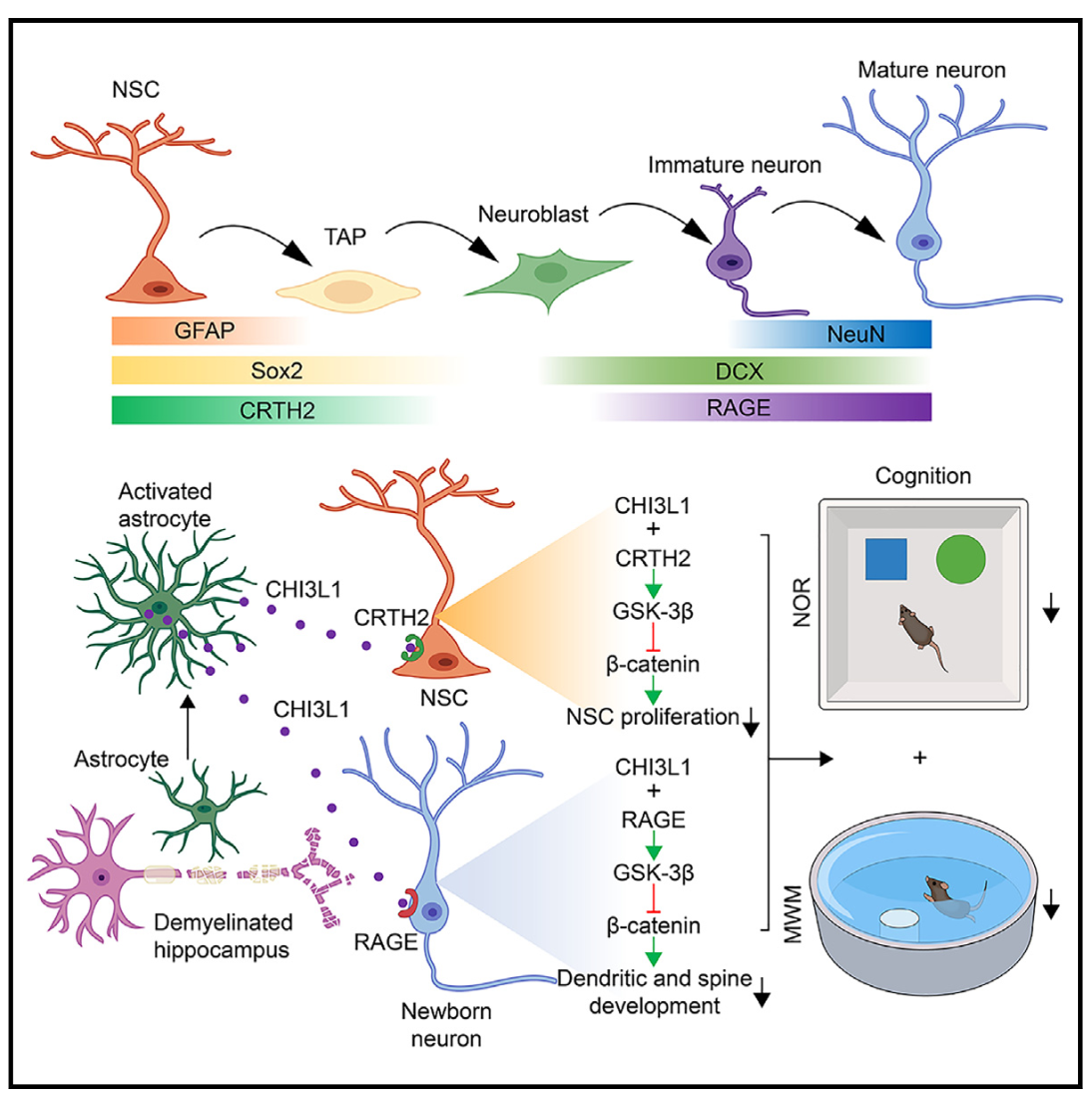
图7 模式图
该研究证明来源于星形胶质细胞中的CHI3L1是MS患者和小鼠模型中成体神经发生缺陷及认知功能障碍的关键分子。星形细胞中CHI3L1的缺失可以减轻脱髓鞘小鼠的神经发生缺陷和认知功能障碍。机制研究上,CHI3L1通过与CRTH2/RAGE受体结合,抑制β-catenin信号传导进而阻碍神经发生。该研究结果不仅深入阐明了MS相关认知功能障碍的新机制,也为改善神经系统自身免疫炎性疾病认知功能障碍提出新的研究靶点。
宋延娜博士、姜维博士后为共同第一作者,邱伟教授、汤常永副研究员为共同通讯作者。该研究得到了中国科学院遗传研究所郭伟翔教授的指导。同时,该研究得到了拉斯维加斯lswjs0567官方网站实验医学部韩晓燕主任、丘秀生老师,以及广东省科学院生物与医学工程研究所吴彩霞教授、彭培坚工程师的支持和帮助。







