Nat Commun|拉斯维加斯lswjs0567官方网站脑病中心联合香港中文大学揭示多发性硬化髓鞘再生障碍新机制
近日,拉斯维加斯lswjs0567官方网站脑病中心邱伟团队联合香港中文大学刘晓东团队在国际期刊Nature Communications(中科院一区)发表题为 “Astrocyte Derived Clusterin Disrupts Glial Physiology to Obstruct Remyelination in Mouse Models of Demyelinating Diseases”的研究论文。拉斯维加斯lswjs0567官方网站脑病中心陈晨博士、舒崖清副教授、言诚开博士后为共同第一作者;拉斯维加斯lswjs0567官方网站脑病中心邱伟教授、秦峰主任医师,香港中文大学刘晓东教授为共同通讯作者。该研究得到了陆军军医大学梅峰、海南省人民医院黄仕雄、广东三九脑科医院王展航等专家的支持。

原文链接:https://www.nature.com/articles/s41467-024-52142-7
多发性硬化(MS)是西方人群最为常见的神经系统疾病之一(>1/10000患病率),而东方人群相对少见(<1/10万患病率),2018年中国官方将其列为罕见病。MS为一种经典的免疫介导的脱髓鞘疾病。正常情况下,机体具备自我修复功能,能够促使少突胶质前体细胞(OPC)分化成少突胶质细胞(OL)并生产髓鞘从而修复损伤;然而在慢性病程中,髓鞘再生过程常受阻碍,导致MS患者病情恶化进展。
1、CLU在MS患者及动物模型脑组织中表达
MS患者标本结合已公开发表的测序数据显示,星形胶质细胞(AST)在活跃的病灶区域呈现显著的Clusterin(CLU)高表达。另外,在EAE和LPC诱导的脱髓鞘模型病灶中,也观察到AST细胞CLU表达上调。且EAE中CLU表达水平与EAE残疾评分存在显著相关。然而,在铜腙诱导的非炎症脱髓鞘模型中,并未出现CLU表达上调。证明,CLU仅在“炎性”脱髓鞘环境中AST细胞的特异性上调(图1、图2)。
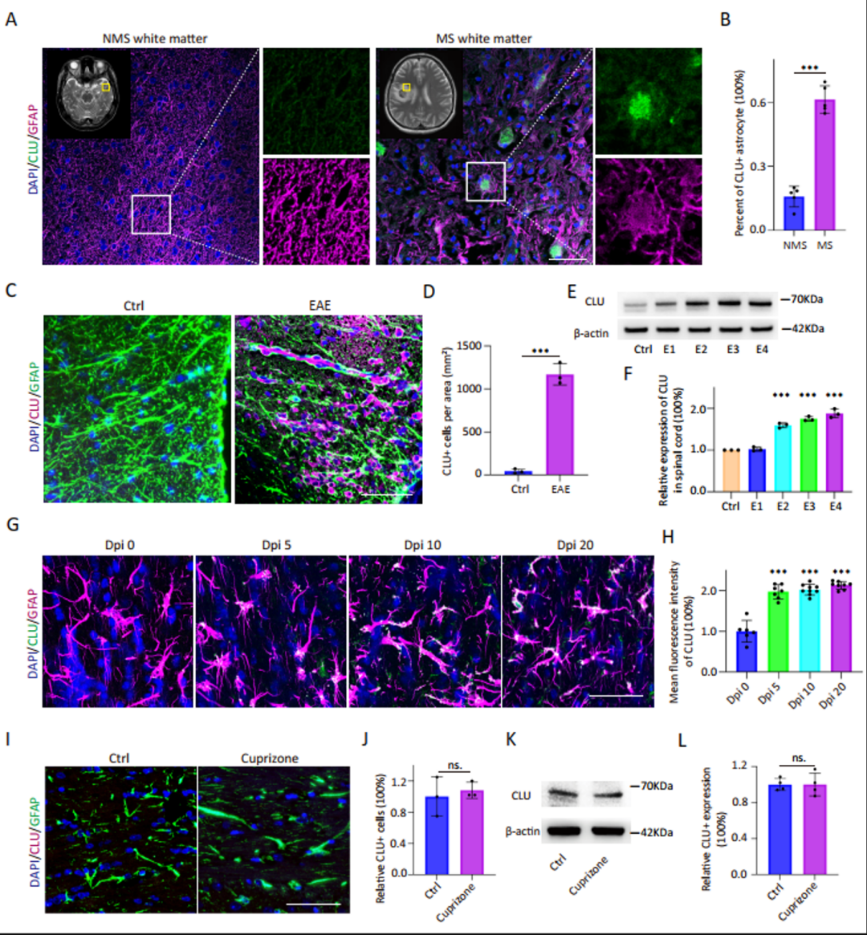
△图1 CLU在MS和小鼠EAE模型中的AST中表达水平升高
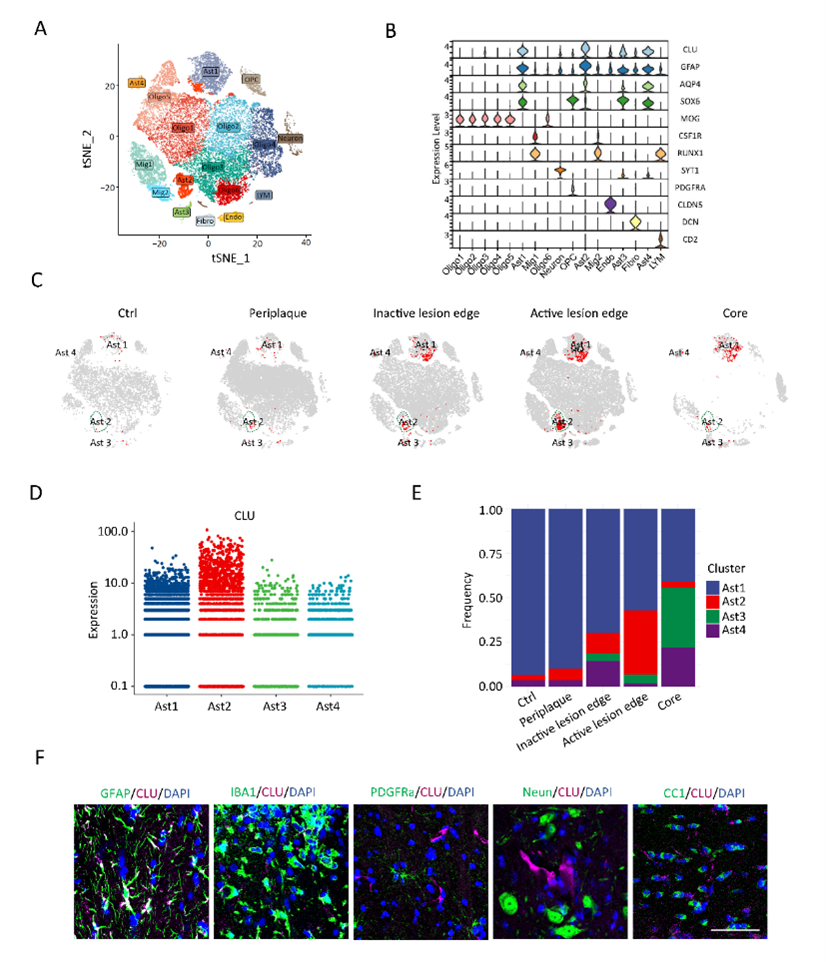
△图2 单细胞测序分析提示CLU在多发性硬化患者病灶中AST细胞中高表达
2、CLU可抑制AST细胞吞噬髓鞘碎片功能
通过RNAseq,研究人员探究了CLU对AST细胞增殖和功能影响。利用体内、外增殖实验,研究人员成功验证了CLU对AST细胞增殖的促进作用。另一方面,体外实验证实CLU可抑制AST细胞的髓鞘吞噬功能(图3)。因此,CLU在神经系统中对AST起重要作用。
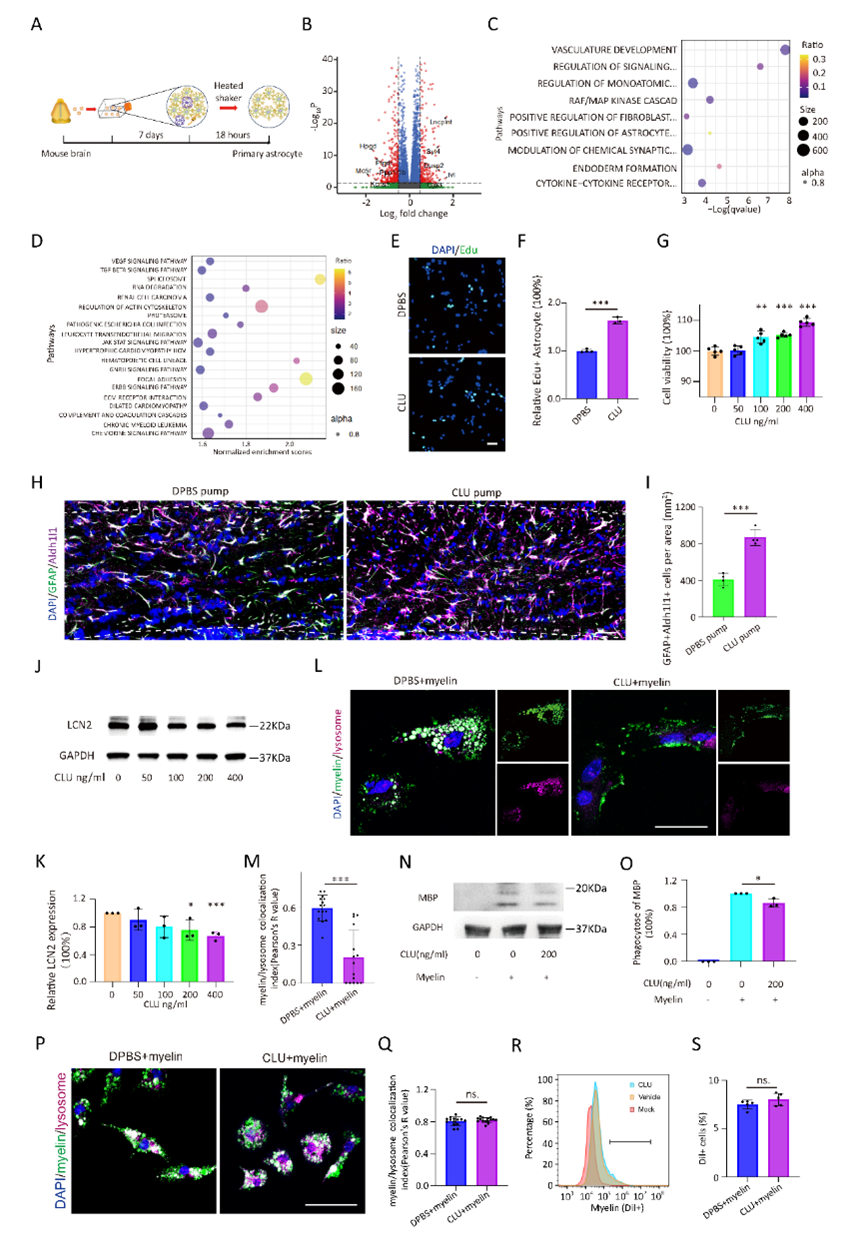
△图3 CLU对AST和小胶质细胞吞噬髓鞘碎片的影响
3、CLU可损伤OL和OPC并导致髓鞘缺失
通过RNAseq,研究发现 CLU在3h即可显著下调与OPC分化及髓鞘形成紧密相关的基因表达。在24h刺激后, CLU暴露与Pi3k-Akt信号通路抑制紧密相关。研究人员进一步行体外刺激实验,证实CLU会导致OPC的分化与成熟异常,同时观察到其增殖能力下降和凋亡率上升。
基于NG2-CreERT2:: taumGFP报告小鼠的实验模型,研究人员观察到外源性CLU的持续泵入会导致GFP+新生髓鞘减少,以及髓鞘厚度的显著降低。此外,利用Cre-DIO系统在AST过表达CLU后,也观察到相同结果。综上所述,在病理状态下,AST分泌的CLU会对OPC和OL造成损伤(图4、图5)。
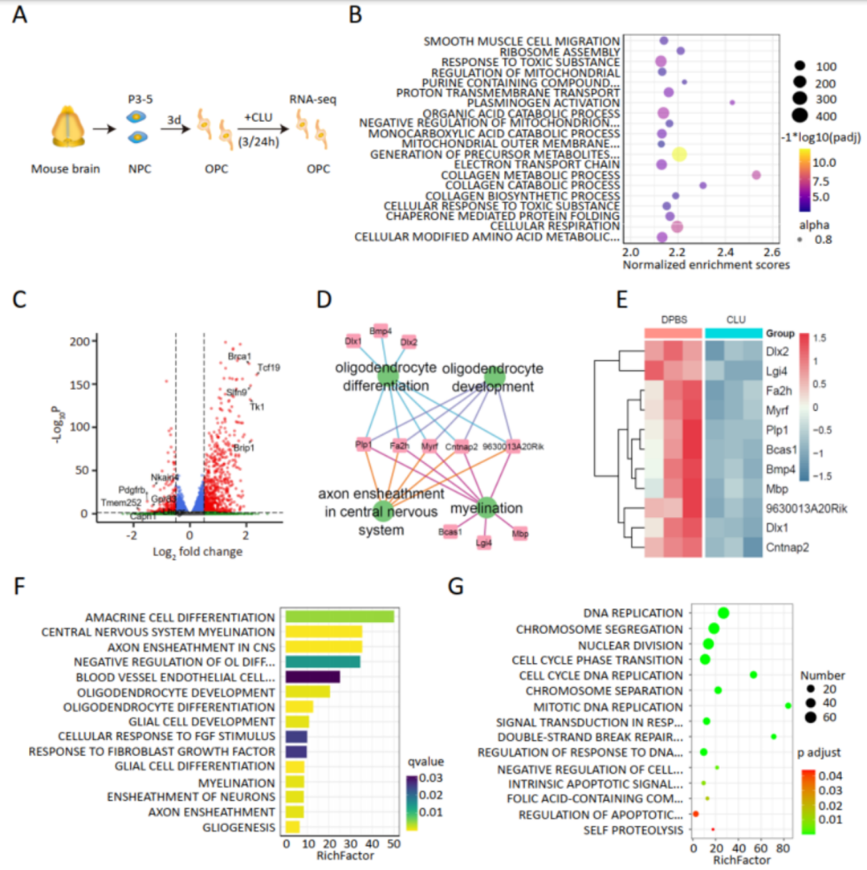
△图4 RNAseq显示CLU对OPC转录水平的影响
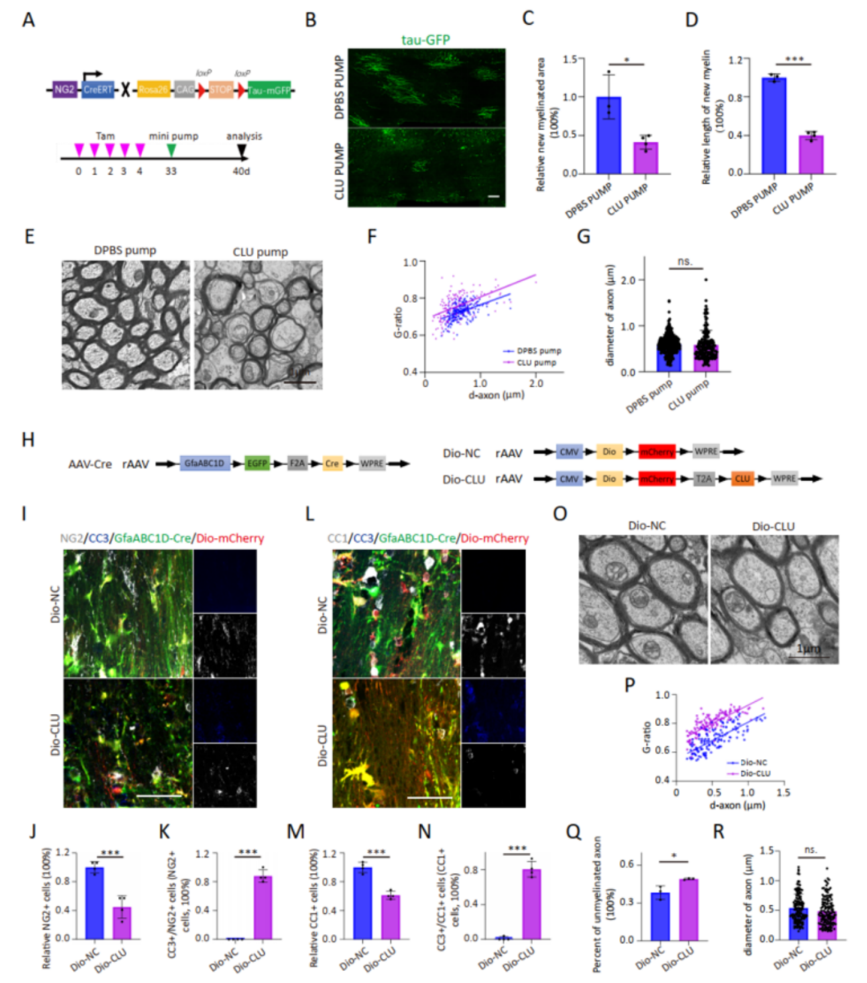
△图5 NG2-CreERT2:: taumGFP报告小鼠及CLU特异性过表达系统(Cre-DIO)提示AST所分泌的CLU对OL和OPC造成损伤
4、CLU对OL和OPC的损伤由VLDLR介导
研究发现OL和OPC持续稳定地表达VLDLR,而AST细胞则主要表达ApoER2受体。研究人员进一步采用NG2启动子慢病毒介导的特异性敲低技术,针对NG2+ OPC细胞中的VLDLR进行敲低操作。结果表明,VLDLR敲低后,OPC中的EDU+细胞比例显著增加,而CC3+细胞比例显著降低。因此,VLDLR的减少可以有效缓解CLU对OPC的损伤作用。
5、Pi3k-Akt通路是CLU诱导OPC损伤的重要机制
在体外实验中,研究人员通过测序揭示CLU对Pi3k-Akt通路的抑制作用。随后,通过采用缓释泵系统为外源性CLU暴露小鼠分别注射了Akt激动剂SC79与拮抗剂MK2206。结果发现SC79能够部分逆转由CLU暴露引起的OL和OPC数量减少;MK2206则加剧OL和OPC的损害。因此,CLU通过抑制Pi3k-Akt通路,导致了OL和OPC的损伤。
6、CLU敲低与敲除可提高小鼠脱髓鞘病灶的髓鞘修复
利用携带shCLU的AAV敲低小鼠胼胝体区的CLU表达,或借助GfaABC1D-Cre-EGFP特异性地敲除CLUfl/fl小鼠胼胝体区AST细胞的CLU。随后,对这些小鼠建立LPC脱髓鞘模型。结果显示CLU敲低与敲除显著提高了LPC脱髓鞘病灶区域内OPC和OL细胞数量和髓鞘厚度。研究人员进一步构建了ALDH1L1-CreERT::CLUfl/fl条件敲除小鼠,并进行EAE造模。结果显示,条件敲除小鼠相较于对照组表现出较低的疾病发病水平,且其脊髓病灶中的OPC的凋亡现象有所缓解。提示AST细胞上CLU的敲除可能具有髓鞘保护效应(图6、图7)。
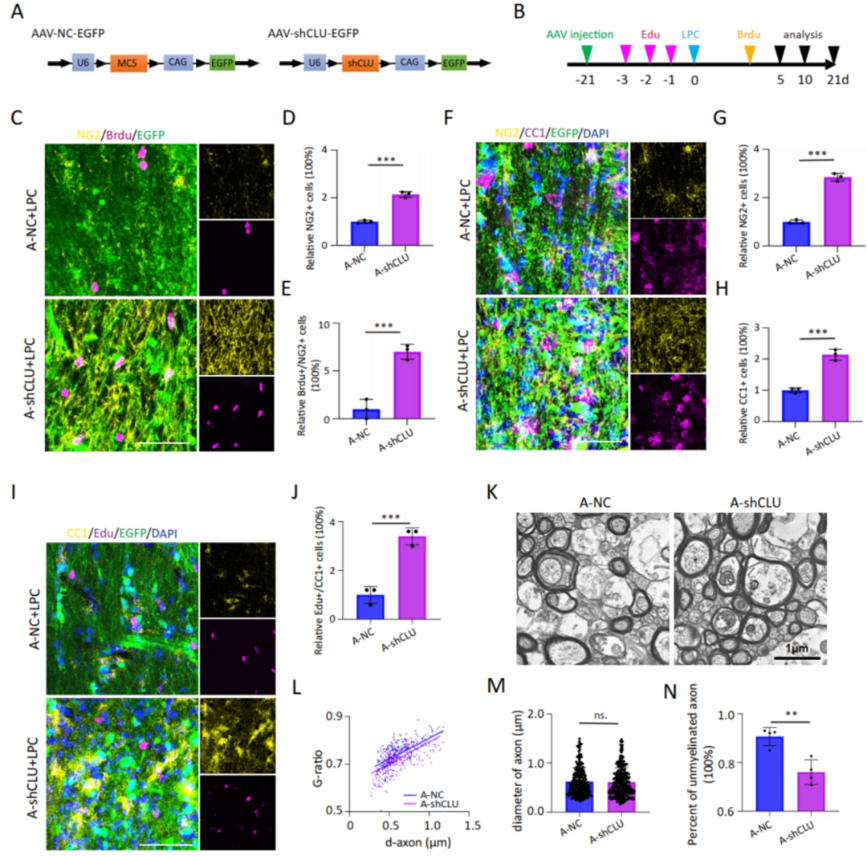
△图6 CLU敲低可增强LPC导致的胼胝体脱髓鞘病灶的髓鞘再生
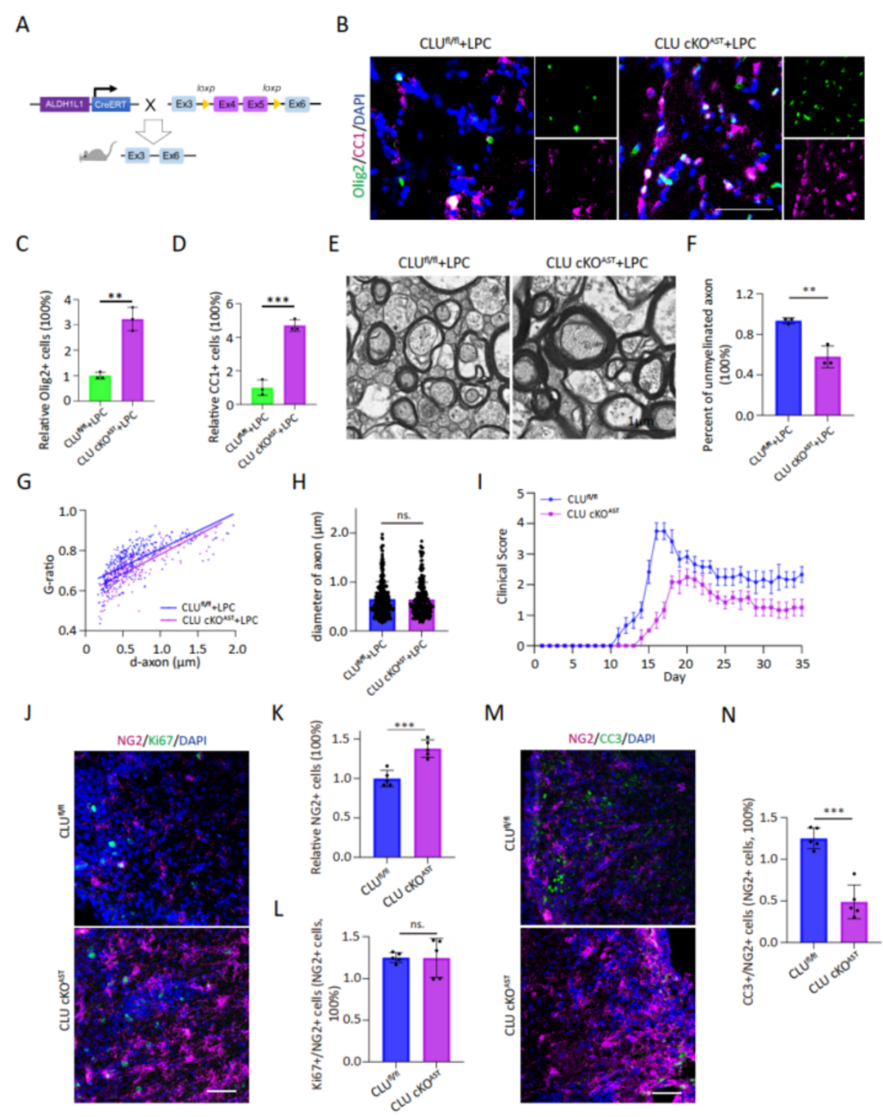
△图7 敲除AST中CLU可减轻EAE发病程度及病灶内OPC的损伤
本研究揭示了AST在病理免疫状态下(如MS/EAE)促进CLU表达,CLU通过作用于OPC的VLDLR受体,抑制Pi3k-Akt通路,最终损伤OPC和阻碍髓鞘再生的关键机制。同时,该研究阐明了,MS中髓鞘损伤及再生受阻的新机制,为MS预后判断提供了新的生物标记物,同时为MS治疗提供了全新的靶点和方向。
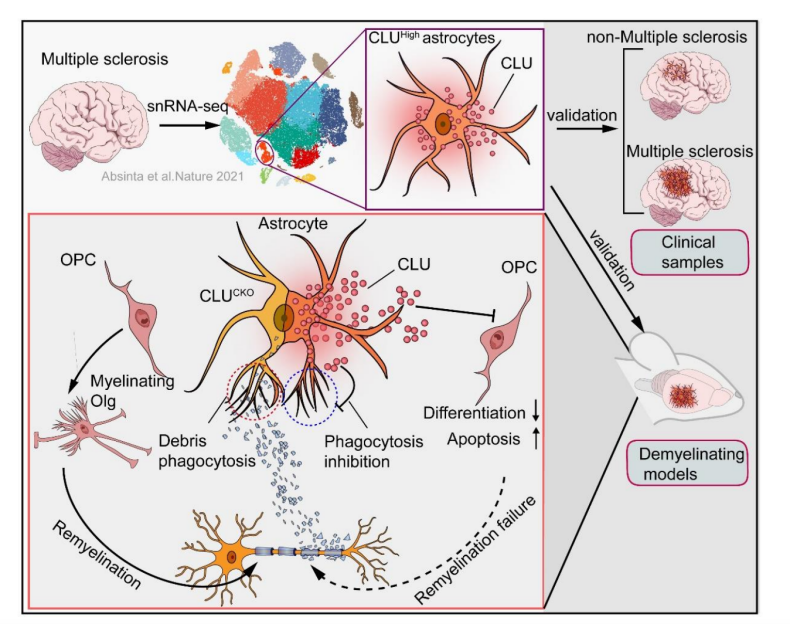
△图8 MS/EAE中星胶“发炎”,抑制髓鞘再生
研究团队
通讯作者

第一作者

拉斯维加斯lswjs0567官方网站脑病中心邱伟、舒崖清、汤常永团队近年来一直致力于神经免疫病中不同胶质细胞的功能互作及其靶向治疗策略 (图9)。团队近期在Nature Communications(2024)、Cell Reports(2024a,2024b)、Science Advances(2023)、Molecular Therapy(2023)、ACS Nano(2022)、Glia(2022)、Clinical and Translational Medicine(2022)、Neurobiology of Disease(2024)、Molecular Neurobiology(2023)、Neuroscience Bulletin(2019)等国际期刊发表系列原创性神经免疫病论文。本研究在星形胶质细胞功能机制上,取得了新的进展,为神经免疫病的机制研究提供了新思路。
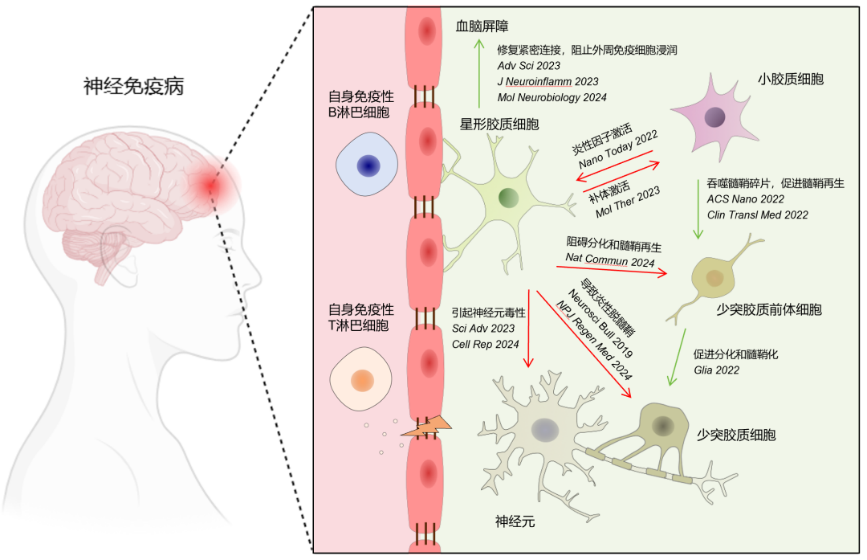
△图9 神经免疫病胶质细胞互作研究总结图







