【中心科研】Advanced Science∣拉斯维加斯lswjs0567官方网站脑病中心团队最新发现:慢性应激通过诱导中性粒细胞胞外网捕加剧脑淀粉样血管病
脑淀粉样血管病(Cerebral amyloid angiopathy, CAA)是最常见的增龄相关性脑小血管病1。其病理生理学过程提示,β淀粉样蛋白(Amyloid protein beta, Aβ)在脑小血管壁中沉积并引起血脑屏障破坏,最终造成脑出血或认知功能障碍2。此外,多项研究还表明焦虑抑郁情绪促进脑淀粉样血管病的病情进展3。新近发现中性粒细胞遇到Aβ后发生NETosis并参与多种肿瘤、卒中等慢性、急性炎症性疾病4,5,然而,其在CAA等脑小血管病中的作用仍有待发掘。
近日,拉斯维加斯lswjs0567官方网站脑病中心陆正齐教授/蔡蔚副研究员团队于Advanced Science(中科院一区)在线发表长文“Chronic Stress Exacerbates Cerebral Amyloid Angiopathy through Promoting Neutrophil Extracellular Traps formation”,报道焦虑情绪加剧中性粒细胞发生NETosis并促进CAA的病情进展,开拓了负性情绪加剧的神经炎症在脑小血管病发病机制中的研究思路。

原文链接:https://doi.org/10.1002/advs.202404096
研究概述
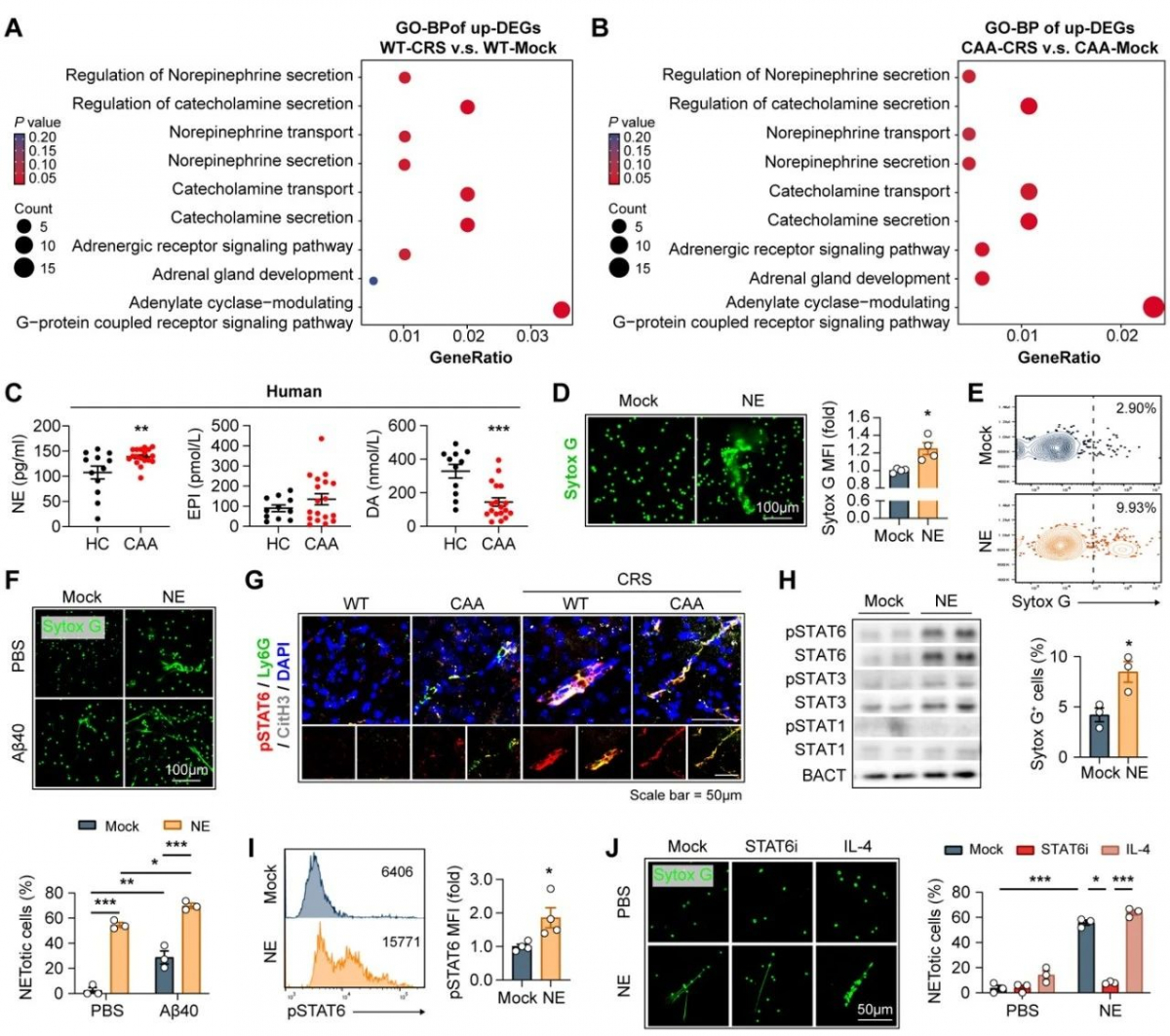
在该研究中,我们发现CAA小鼠模型慢性应激后β淀粉样蛋白1-40沉积增加,血管壁紧密连接蛋白破坏及脱髓鞘也随之增加,通过Bulk-RNA测序发现慢性应激后CAA小鼠脑中中性粒细胞浸润增加,并同样在CAA患者中观察到焦虑自评量表评分SAS与外周血中性粒细胞的数量呈正相关。
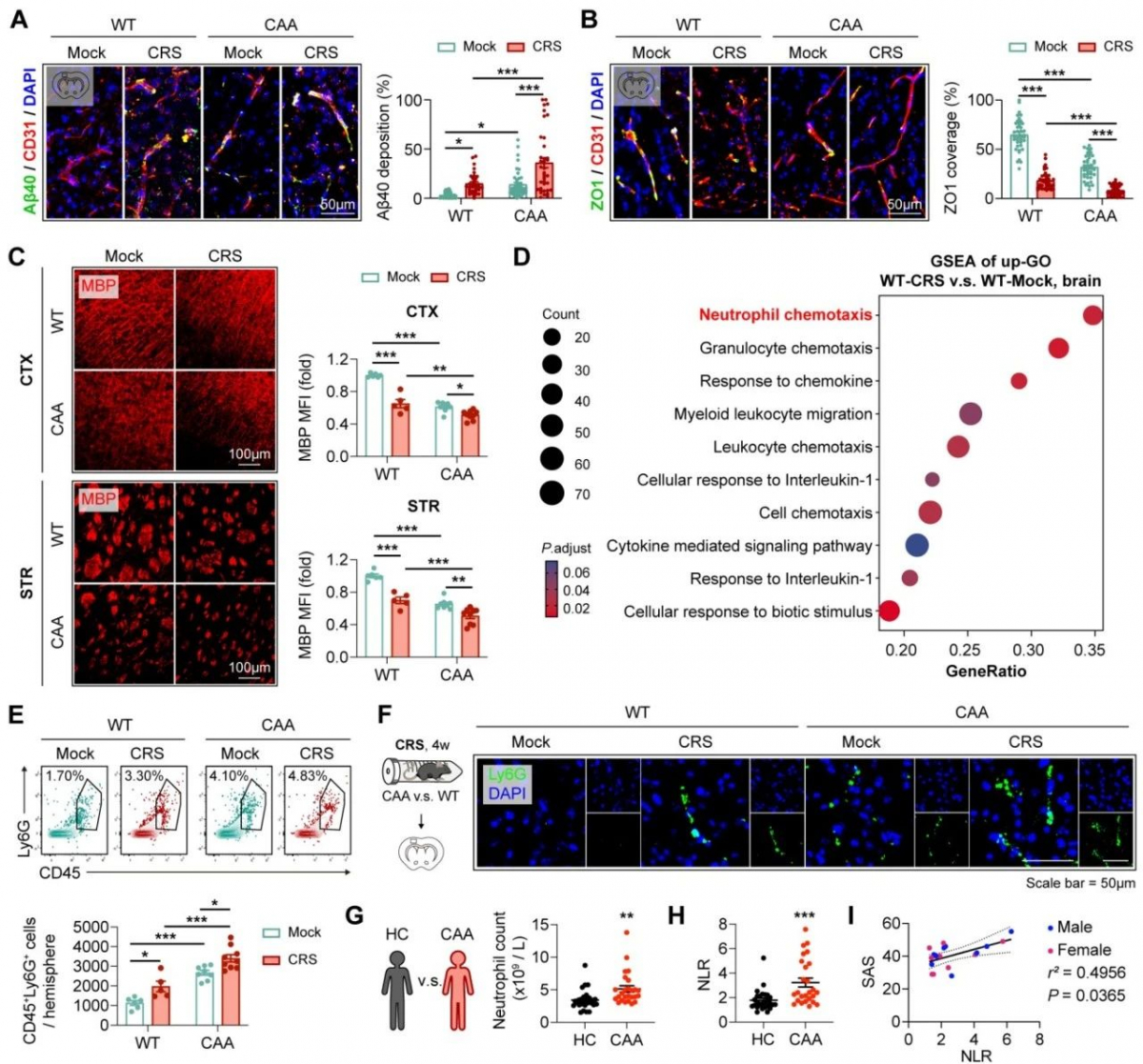
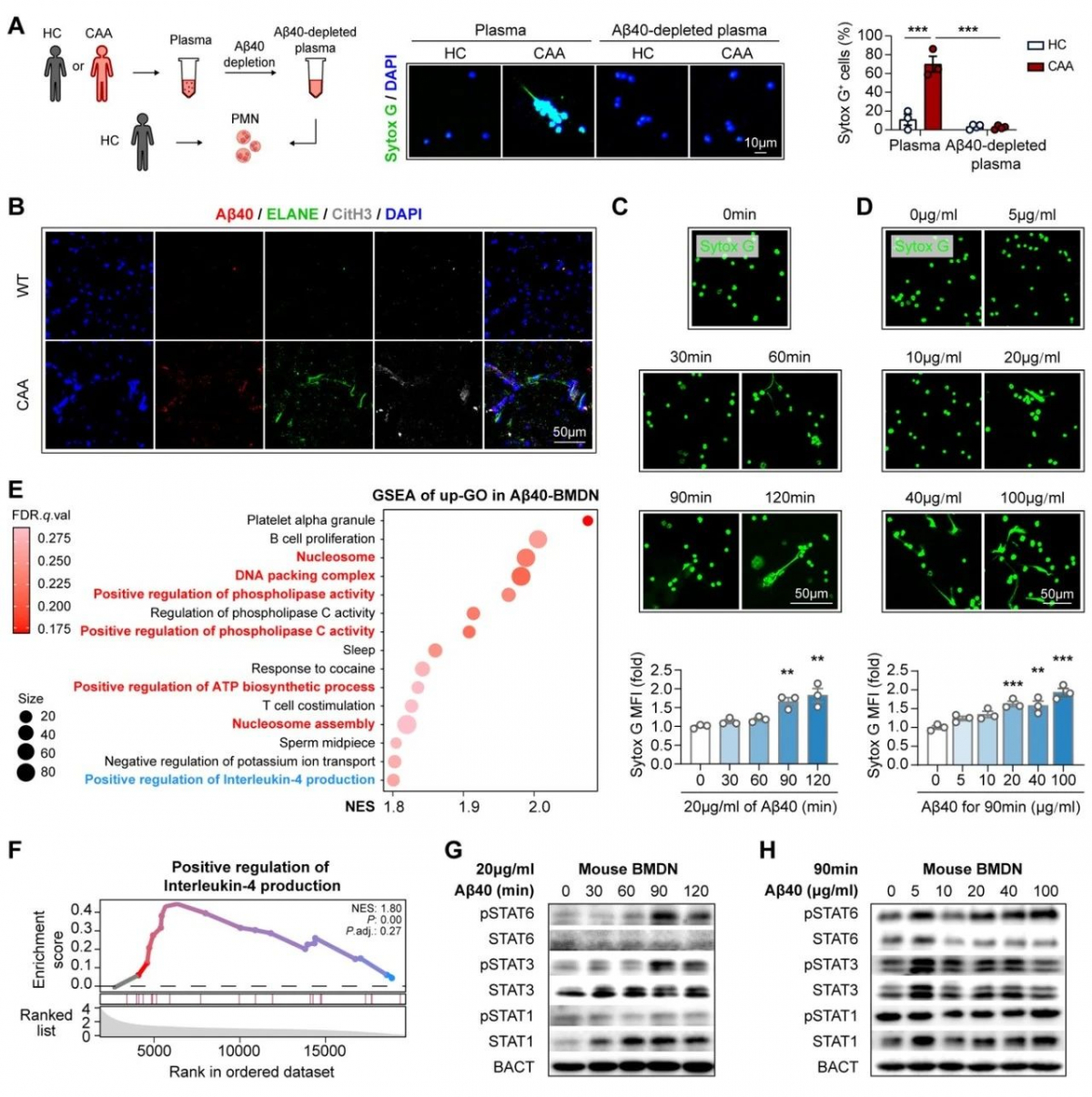
进一步探究发现CAA模型小鼠中沉积于脑血管中的β淀粉样蛋白1-40(Amyloid protein beta 1-40, Aβ40)可诱导中性粒细胞浸润并发生NETosis,并随着年龄的增加,脑血管中β淀粉样蛋白1-40的增加,中性粒细胞的浸润及NETosis 的发生加剧。应用抑制中性粒细胞浸润的CXCR2抑制剂SB225002及中性粒细胞NETosis抑制剂GSK484,能够有效地缓解CAA小鼠模型中脑血管壁紧密连接蛋白的破坏及脱髓鞘,说明中性粒细胞及其胞外网捕死亡参与CAA的病情进展。
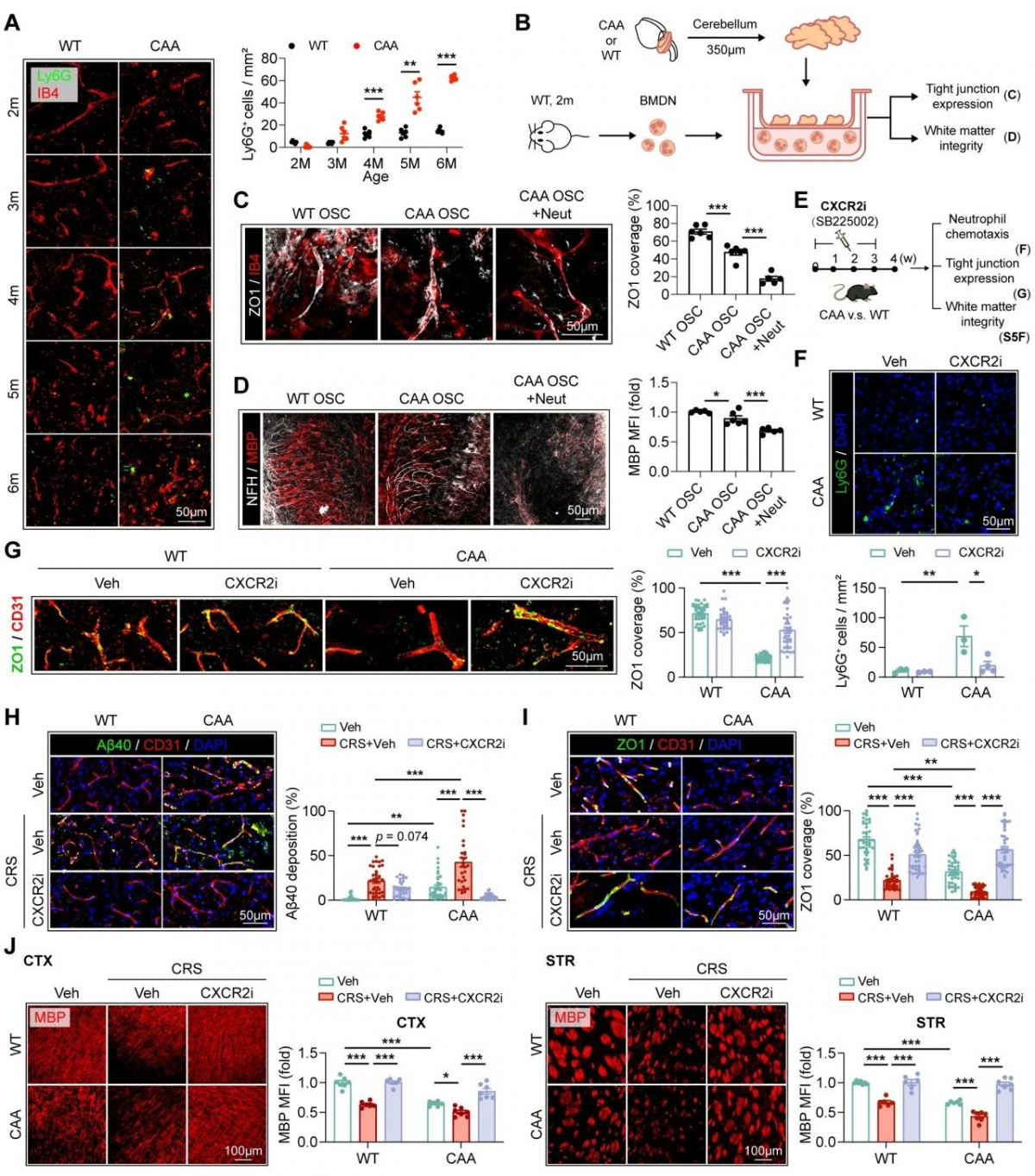
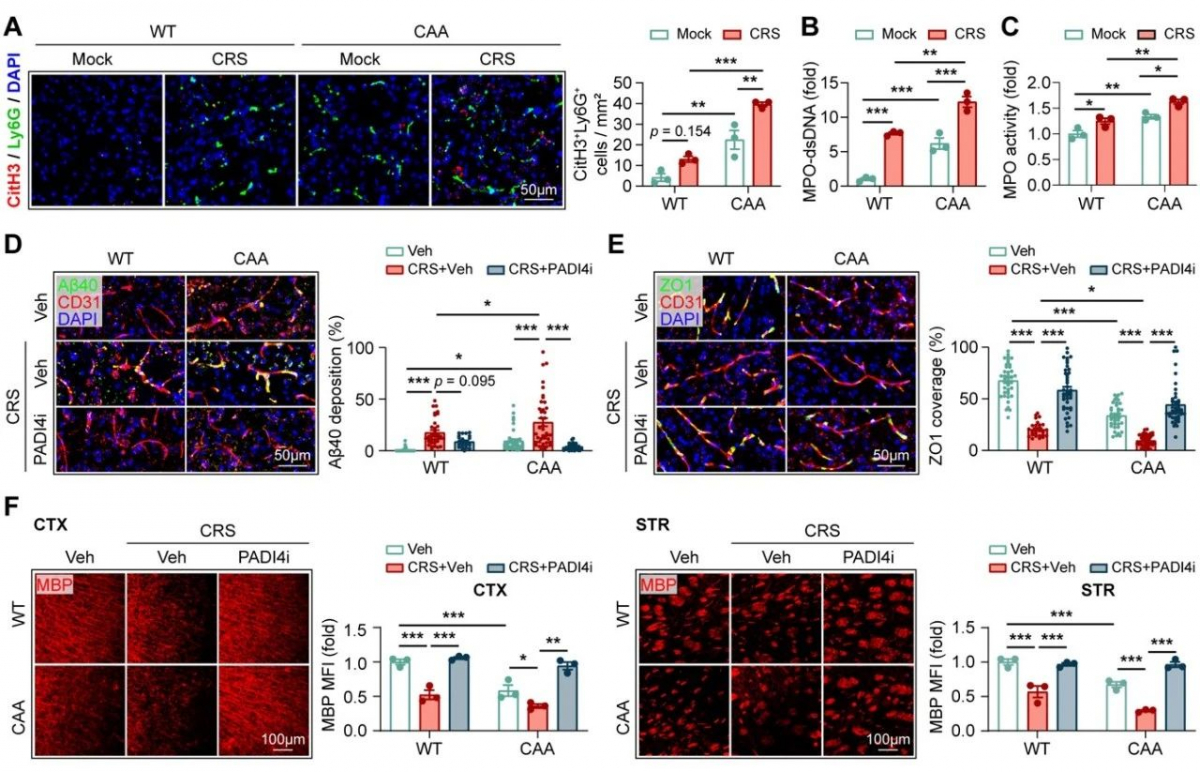
同时,CAA小鼠模型慢性应激造模后脑血管中β淀粉样蛋白1-40沉积增加同样伴随着中性粒细胞浸润、NETosis的增加及CAA病情的加剧,应用抑制中性粒细胞浸润的CXCR2抑制剂SB225002及中性粒细胞NETosis抑制剂GSK484能够有效缓解负性情绪引起的CAA病情的进展,说明焦虑抑郁情绪同样通过诱导中性粒细胞发生网捕死亡进而影响CAA的病情进展。
研究意义
上述发现提示,慢性压力通过促进中性粒细胞发生NETosis,增强了脑血管中淀粉样蛋白β的沉积,并加剧了随后的脑损伤,促进了脑淀粉样血管病的进展。抑制中性粒细胞向脑的趋化或抑制NET的形成都能在慢性压力的背景下减轻CAA的病情。研究揭示了CAA中固有免疫细胞在负性情绪下破坏血脑屏障的新机制,为研发针对CAA的特异有效的治疗方法的临床转化奠定了基础。
研究团队
本研究由拉斯维加斯lswjs0567官方网站精神与疾病研究中心(脑病中心)脑血管病团队完成。该文的共同第一作者是黄惠蓬博士和邓晓晖博士,通讯作者为陆正齐教授、蔡蔚副研究员。陆正齐教授课题组长期致力于研究脑血管病的免疫机制及干预靶点。团队的前期研究表明,Aβ40诱导巨噬细胞产生的迁移小体参与CAA的发病机制6,填补了固有免疫在脑小血管病发病机制中的空白。本研究是该团队在脑血管病治疗领域的系列研究中的重要成果之一,并且为下一步临床转化提供了新思路。
参考文献
1.Biffi A, Greenberg SM. Cerebral amyloid angiopathy: a systematic review. J Clin Neurol. 2011;7(1):1-9.
2.Kellie JF, Campbell BCV, Watson R, et al. Amyloid-beta (Abeta)-Related Cerebral Amyloid Angiopathy Causing Lobar Hemorrhage Decades After Childhood Neurosurgery. Stroke. 2022;53(8):e369-e374.
3.Smith EE, Crites S, Wang M, et al. Cerebral Amyloid Angiopathy Is Associated With Emotional Dysregulation, Impulse Dyscontrol, and Apathy. J Am Heart Assoc. 2021;10(22):e022089.
4.Castanheira FVS, Kubes P. Neutrophils and NETs in modulating acute and chronic inflammation. Blood. 2019;133(20):2178-2185.
5.Munir H, Jones JO, Janowitz T, et al. Stromal-driven and Amyloid beta-dependent induction of neutrophil extracellular traps modulates tumor growth. Nat Commun. 2021;12(1):683.
6.Hu M, Li T, Ma X, et al. Macrophage lineage cells-derived migrasomes activate complement-dependent blood-brain barrier damage in cerebral amyloid angiopathy mouse model. Nat Commun. 2023;14(1):3945.







